Правило Гунда (Хунда) определяет порядок заселения электронами орбиталей, имеющих одинаковую энергию. Оно было выведено немецким физиком-теоретиком Ф. Гундом (Хундом) в 1927 г. на основе анализа атомных спектров.
Согласно правилу Гунда, заселение орбиталей, относящихся к одному и тому же энергетическому подуровню, начинается одиночными электронами с параллельными (одинаковыми по знаку) спинами, и лишь после того, как одиночные электроны займут все орбитали, может происходить окончательное заселение орбиталей парами электронов с противоположными спинами. В результате суммарный спин (и сумма спиновых квантовых чисел) всех электронов в атоме будет максимальным.
Например, атом азота имеет три электрона, находящиеся на 2 р -подуровне. Согласно правилу Гунда, они должны располагаться поодиночке на каждой из трех 2 р -орбиталей. При этом все три электрона должны иметь параллельные спины: 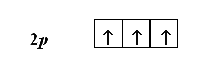
4) Периодический закон и Периодическая система химических элементов
Открытие Периодического закона
Основной закон химии - Периодический закон был открыт Д.И. Менделеевым в 1869 году в то время, когда атом считался неделимым и о его внутреннем строении ничего не было известно.
В основу Периодического закона Д.И. Менделеев положил атомные массы (ранее - атомные веса) и химические свойства элементов.
Расположив 63 известных в то время элемента в порядке возрастания их атомных масс, Д.И. Менделеев получил естественный (природный) ряд химических элементов, в котором он обнаружил периодическую повторяемостьхимических свойств.
Например, свойства типичного металла литий Li повторялись у элементов натрий Na и калий K, свойства типичного неметалла фтор F - у элементов хлор Cl, бром Br, иод I.
У некоторых элементов Д.И. Менделеев не обнаружил химических аналогов (например, у алюминия Al и кремния Si), поскольку такие аналоги в то время были еще неизвестны. Для них он оставил в естественном ряду пустые места и на основе периодической повторяемости предсказал их химические свойства.
После открытия соответствующих элементов (аналога алюминия - галлия Ga, аналога кремния - германия Ge и др.) предсказания Д.И. Менделеева полностью подтвердились.
Периодический закон в формулировке Д.И. Менделеева:
| Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов. |
На основе Периодического закона Д.И. Менделеев создал Периодическую систему химических элементов.
Периоды - это горизонтальные ряды таблицы, они подразделяются на малые и большие. В малых периодах находится 2 элемента (1-й период) или 8 элементов (2-й, 3-й периоды), в больших периодах - 18 элементов (4-й, 5-й периоды) или 32 элемента (6-й, 7-й период). Каждый период начинается с типичного металла, а заканчивается неметаллом (галогеном) и благородным газом.
Группы - это вертикальные последовательности элементов, они нумеруется римской цифрой от I до VIII и русскими буквами А и Б. Короткопериодный вариант Периодической системы включал подгруппы элементов (главную и побочную).
Подгруппа - это совокупность элементов, являющихся безусловными химическими аналогами; часто элементы подгруппы обладают высшей степенью окисления, отвечающей номеру группы.
По периоду слева направо:
заряд ядра атома - увеличивается;
радиус атома - уменьшается;
количество электронов на внешнем уровне - увеличивается;
электроотрицательность - увеличивается;
отдача электронов - уменьшается;
прием электронов - увеличивается.
По группе сверху вниз:
заряд ядра атома - увеличивается;
радиус атома - увеличивается;
количество электронов на внешнем уровне - не изменяется;
электроотрицательность - уменьшается;
отдача электронов - увеличивается;
прием электронов - уменьшается.
Подгруппы, в которых расположены s- и p-элементы, называют ГЛАВНЫМИ, а подгруппы с d-элементами - ПОБОЧНЫМИ ПОДГРУППАМИ.
5) Энергия связи – это энергия, необходимая для разрыва химической связи. Энергии разрыва и образовании связи равны по величине, но противоположны по знаку. Чем больше энергия химической связи, тем устойчивее молекула. Обычно энергию связи измеряют в кДж/моль. Например, на разрыв связи H–H затрачивается 432,1 кДж/моль энергии.
Для многоатомных соединений с однотипными связями за энергию связи
принимается среднее ее значение, рассчитанное делением суммарной энергии данных связей на число связей. Так, на разрыв четырех связей в молекуле метана CH4 – 1648 кДж/∙моль и в этом случае EC–H = 1648: 4 = 412 кДж/моль.
Длина связи – это расстоянию между ядрами взаимодействующих атомов в соединении. Измеряется в нанометрах (10–9 м). Иногда применяется Å (ангстрем = 10–8 см).
Валентный угол – это угол между двумя химическими связями. Он отражает геометрию молекулы.
6) Ионная связь.
Ионная связь образуется при взаимодействии атомов, которые резко
отличаются друг от друга по электроотрицательности. Например, типичные металлы
литий(Li), натрий(Na), калий(K), кальций
(Ca), стронций(Sr), барий(Ba) образуют ионную связь с
типичными неметаллами, в основном с галогенами.
Ковалентная неполярная связь.
При взаимодействии атомов с одинаковой электроотрица-тельностью образуются молекулы с ковалентной неполярной связью. Такая связь существует в молекулах следующих простых веществ: H2, F2, Cl2, O2, N2
Ковалентная полярная связь.
При взаимодействии атомов, значение
электроотрецательностей которых отличаются, но не резко, происходит смещение
общей электронной пары к более электроотрицательному атому. Это наиболее распространенный тип химической связи, которой встречается
как в неорганических, так и органических соединениях.
К ковалентным связям в полной мере относятся и те связи, которые образованы по
донорно-акцепторному механизму, например в ионах гидроксония и амония.
Металлическая связь.
Связь, которая образуется в результате взаимодействия относите-льно свободных электронов с ионами металлов, называются металлической связью. Этот тип связи характерен
для простых веществ- металлов.
Водородная связь.
Связь, которая образуется между атомов
водорода одной молекулы и атомом сильно электроотрицательного элемента (O,
N, F) другой молекулы, называется водородной связью.
7) Ковалентная связь. Метод валентных связей
Химическая связь, осуществляемая общими электронными парами, возникающих в оболочках связываемых атомов, имеющих антипараллельные спины, называется атомной, или ковалентной связью. Ковалентная связь двухэлектронная и двуцентровая (удерживает ядра). Она образуется атомами одного вида – ковалентная неполярная – новая электронная пара, возникшая из двух неспаренных электронов, становится общей для двух атомов хлора; и атомами разного вида, сходных по химическому характеру – ковалентная полярная. Элементы с большей электроотрицательностью (Cl) будут оттягивать общие электроны от элементов с меньшей электроотрицательностью (Н). Атомы с непарными электронами, имеющими параллельные спины, отталкиваются – химическая связь не возникает. Способ образования ковалентной связи называется обменным механизмом.
Свойства ковалентной связи. Длина связи – межъядерное расстояние. Чем это расстояние короче, чем прочнее химическая связь. Энергия связи – количество энергии, требующееся для разрыва связи. Величина кратности связи прямо пропорциональна энергии связи и обратно пропорциональна длине связи. Направленность связи –определенное расположение электронных облаков в молекуле. Насыщаемость – способность атома образовывать определенное количество ковалентных связей. Химическая связь, образованная перекрыванием электронных облаков вдоль оси, соединяющей центры атомов, называется?-связью. Связь, образованная перекрыванием электронных облаков перпендикулярно оси, соединяющей центры атомов, называется?-связью. Пространственная направленность ковалентной связи характеризуется углами между связями. Эти углы называются валентными углами. Гибридизация – процесс перестройки неравноценных по форме и энергии электронных облаков, ведущих к образованию одинаковых по тем же параметрам гибридных облаков. Валентность – число химических связей (ковалентных), посредством которых атом соединен с другими. Электроны, участвующие в образовании химических связей, называются валентными. Число связей между атомами равно числу его неспаренных электронов, участвующих в образовании общих электронных пар, поэтому валентность не учитывает полярность и не имеет знака. В соединениях, в которых отсутствует ковалентная связь, имеет местостепень окисления – условный заряд атома, исходный из предположения, что оно состоит из положительно или отрицательно заряженных ионов. К большинству неорганических соединений применимо понятие степень окисления.
обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору)
8) Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции: концентрации с, температуры t, присутствия катализаторов, а также от некоторых других факторов (например, от давления - для газовых реакций, от измельчения - для твердых веществ, от радиоактивного облучения).
Влияние концентраций реагирующих веществ. Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает реакция. Число же столкновений тем больше, чем выше концентрация реагирующих веществ. Отсюда на основе обширного экспериментального материала сформулирован основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ:
Cкорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
Для реакции (I) этот закон выразится уравнением
v = kcA cB, (1)
где сА и сВ - концентрации веществ А и В, моль/л; k - коэффициент пропорциональности, называемый константой скорости реакции. Основной закон химической кинетики часто называют законом действующих масс.
Из уравнения (1) нетрудно установить физический смысл константы скорости k: она численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1 моль/л или когда их произведение равно единице.
Константа скорости реакции k зависит от природы реагирующих веществ и от температуры, но не зависит от их концентраций.
Уравнение (1), связывающее скорость реакции с концентрацией реагирующих веществ, называется кинетическим уравнением реакции. Если опытным путем определено кинетическое уравнение реакции, то с его помощью можно вычислять скорости при других концентрациях тех же реагирующих веществ.
Влияние температуры.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа:
При повышении температуры на каждые 10о скорость большинства реакций увеличивается в 2-4 раза.
Математически эта зависимость выражается соотношением
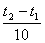
vt 2 = vt 1 γ,
где vt 1, vt 2 - скорости реакции соответственно при начальной (t 1) и конечной (t 2) температурах, а γ - температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции с повышением температуры реагирующих веществ на 10°.
Правило Вант-Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции. Температура влияет на скорость химической реакции, увеличивая константу скорости.
ЭНЕРГИЯ АКТИВАЦИИ, наименьшее количество энергии, необходимое для начала химической реакции. Помере того, как в ходе реакции химические связи разрываются или формируются, энергия системыувеличивается по сравнению с энергией исходных веществ, достигает максимума, а затем уменьшается доуровня энергии конечных продуктов. Разница между энергией исходных веществ и упомянутым максимумоми представляет собой энергию активации. Эта энергия часто передается смеси реагентов путем нагрева,хотя некоторые химические реакции начинаются спонтанно сразу после соединения реагентов.
9) Катализ – изменение скорости химической реакции при воздействии некоторых веществ. Вещества, ускоряющие протекание химической реакции, называются катализаторами, а вещества, замедляющие химическую реакцию,− ингибиторами. Поэтому различают положительный и отрицательный катализ. Каталитических процессов, реализуемых в природе и технике, очень много: реакции, протекающие в живых организмах (ферментативные процессы), переработка нефти с помощью крекинга и риформинга, гидролиз сложных эфиров, получение серной кислоты и т.д. ПРОМОТОР, в химии вещество, применяемое в небольших количествах вместе с катализатором дляувеличения активности КАТАЛИЗАТОРА. Например, в ПРОЦЕССЕ ХАБЕРА железо-катализатор применяетсядля ускорения реакции соединения водорода с азотом под давлением для образования аммиака. Этоткатализатор активизируется небольшим количеством оксида калия, которое и является промотором.
10) Понятие химического равновесия
Равновесным считается состояние системы, которое остается неизменным, причем это состояние не обусловлено действием каких-либо внешних сил. Состояние системы реагирующих веществ, при котором скорость прямой реакции становится равной скорости обратной реакции, называется химическим равновесием. Такое равновесие называется еще подвижным или динамическим равновесием.
 2015-08-21
2015-08-21 11336
11336
