В пищевой промышленности для контроля кислотности различных продуктов и сред широко применяются потенциометрические анализаторы (рН-метры) различной модификации. Их действие основано на потенциометрическом методе измерения концентрации ионов водорода.
Суть метода заключается в измерении разности электрических потенциалов двух электродов. При этом один из них, вспомогательный, имеет постоянный потенциал. Потенциал другого электрода, индикаторного, обусловлен концентрацией ионов водорода в анализируемом растворе. Активность ионов водорода характеризует как кислотные, так и щелочные свойства раствора.
Вода, являясь нейтральной средой, диссоциирует на ионы водорода и гидроксильные ионы:
H2O = (H+)+(OH-).
Константа равновесия диссоциации воды:
К= (H+)∙(OH-)/(H2O).
Концентрацию недиссоциированных молекул воды можно считать постоянной (55,5 М), тогда
КН20=(Н+)∙(ОН-)
где КН20 - константа, называемая ионным произведением воды (КН20 = 10-14 при температуре 22 °С).
В процессе диссоциации воды образуется равное количество ионов водорода и гидроксильных ионов, поэтому их концентрация определяется как:
(Н+)=(ОН-) =10-7 моль/л
Концентрацию ионов водорода принято выражать через рН– отрицательный десятичный логарифм концентрации ионов водорода (Н+):
pН = -lg (H+).
В связи с тем, что в результате электростатического взаимодействия ионов водорода возможны образования ионных пар, величину рН определяют как логарифм активных ионов водорода, взятый с обратным знаком:
рH= -lg [ (H+).f] =lg α H+,
где f - коэффициент активности ионов водорода.
При температуре 22 °С для чистой воды величина рН=7, кислые среды имеют рН <7, щелочные рН >7. Значение величины рН зависит от температуры.
В пищевой промышленности в качестве индикаторных электродов применяются стеклянные, а в качестве вспомогательных – хлорсеребряные.
Корпус индикаторного электрода состоит из калиброванной стеклянной трубки. К её концу приварена мембрана из специального электродного стекла. Форма этой части электрода может быть различной (шарообразной, кольцевидной, игольчатой) в зависимости от вида контролируемого продукта.
Внутренняя часть корпуса заполнена 0,1 Н раствором КС1 с кристаллами хлористого серебра. Внего погружается контактный хлорсеребряный электрод, от которого отходит экранированный кабель.
Стеклянные мембраны изготовляются из сортов стекла, содержащих примеси одновалентных металлов (Na, Li, K), ионы которых под воздействием электростатических сил переходят в раствор. Их места замещаются ионами водорода.
Изготовляемые в настоящее время электроды не подвержены поляризации, загрязнению и могут работать при температурах до 100 °С.
В качестве вспомогательного применяется хлорсеребряный электрод, имеющий пластмассовый корпус с серебряным контактом. Полость вокруг контакта заполнена кристаллическим хлористым серебром. Для препятствия диффузии серебра в раствор применена пористая перегородка, зажатая шайбой.
При погружении индикаторного электрода в анализируемый раствор между поверхностью электрода и раствором вследствие обмена ионами металла и водорода возникает разность потенциалов:
Ех = Е0+ 2,3 RT /F lgαH+,
где Е0 – начальное значение потенциала;
R - универсальная газовая постоянная;
F - число Фарадея.
На рис. 2.58 показана измерительная схема рН - метра. В сосуд с контролируемой средой 10 помещается измерительный электрод 11. Он представляет собой стеклянную пробирку, на конце которой находится шарик 9 из специального литиевого стекла. Внутри электрода находится стержень 12 из бромистого серебра. Пробирка заполняется раствором бромисто-водородной кислоты НВг и закрывается пробкой 1. При опускании электрода в контролируемый раствор ионы лития на поверхности шарика замещаются на ионы водорода из раствора и электрод приобретает положительный электрический потенциал Ех, тем больший, чем больше концентрация ионов водорода, т.е. кислотность среды. Для создания разницы электрических потенциалов служит вспомогательный хлорсеребряный электрод 8. Он представляет собой стеклянную колбу, в которой находится серебряная спираль 2. На конце спирали, выведенной из электрода, находится клемма для подсоединения внешнего провода. Электрод заполняется раствором хлористого серебра AgCl и электрод закрывается пористой пробкой 3. При химическом взаимодействии серебра с раствором AgCl, электрод приобретает постоянный электрический потенциал Еп. Для замыкания электрической цепи служит электролитический ключ 4, представляющий сосуд с трубкой 5, опущенный в контролируемый раствор. Трубка затыкается пробкой 6, сквозь которую пропущен матерчатый фитилек 7. Ключ заполняется раствором хлористого калия КС1. Электрический контакт между растворами AgCl и КС1 происходит через пористую пробку (перегородка) 3, амежду раствором КС1 и контролируемой средой медленным (около 4 мл/сут) перетеканием раствора КС1 по фитильку в контролируемую среду. В качестве измерительного прибора используется специальный милливольтметр или преобразователь сигнала с высокоомным входом, подключаемые к клеммам измерительного и вспомогательного электродов. На входе в измерительный прибор формируется падение напряжения АЕ = Ех- Еп = f(Ex), т. е. пропорциональное потенциалу измерительного электрода.
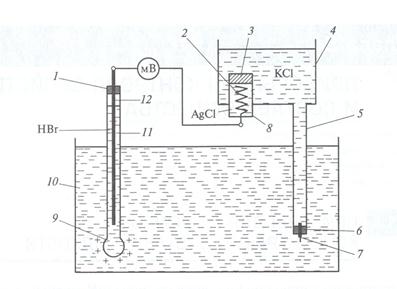
Рис. 2.58. Измерительная схема рН-метра
На рис. 2.59 представлен внешний вид промышленного потенциометра рН-4121, предназначенного для автоматического измерения активности ионов водорода в диапазоне от 0 до 14 рН и температуры от 0 до 100 °С водных сред в комплекте с проточной или погружной арматурой для комбинированного электрода в автоматизированных системах управления технологическими процессами в различных отраслях промышленности, в том числе пищевой.

Рис. 2.59. Потенциометр рН-4121
рН-метр рН-4121 состоит из первичного преобразователя и измерительного прибора. Градуировка прибора выполняется из меню первичного преобразователя. Прибор осуществляет преобразование измеряемых параметров в унифицированный аналоговый выходной сигнал постоянного тока; обеспечивает обмен данными с компьютером по цифровому интерфейсу; сигнализирует при выходе измеряемых параметров за пределы заданных значений.
Существует множество модификаций рН - метров: предназначенных для автоматического измерения параметров среды в потоке, в лабораторных условиях, мобильных приборов. На рис. 2.60. приведен внешний вид pH-метра рН-150MП предназначенного для оперативного определения активности ионов водорода pH, окислительно-восстановительного потенциала Eh и температуры технологических растворов. Имеются модификации этого прибора для измерения pH и Eh мяса, хлебобулочных изделий и полуфабрикатов.

Рис. 2.60. рН-метр-милливольтметр рН-150МП
 2014-02-02
2014-02-02 3245
3245








