4.1. Обратимые и необратимые реакции
Некоторые химические реакции удается провести до конца, т.е. добиться того, чтобы исходные вещества реагировали полностью. Реакции протекающие одновременно в двух противоположных направлениях, называются обратными.
Эти реакции ни в одном направлении не идут до конца, а лишь до строго определенных соотношений исходных и получившихся продуктов.
Рассмотрим общий случай обратимой реакции:
аА + вВ 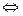 сС + dD
сС + dD
В уравнении прописными буквами A,B,C,D обозначены различные виды молекул, как реагентов, так и продуктов реакции, а строчными буквами a,b,c,d – числовые коэффициенты, показывающие, сколько молекул различного рода участвуют в данной реакции (стехиометрические коэффициенты.)
Знак равенства в уравнении реакции заменяют двумя противоположно направленными стрелками.
При этом реакции, соответствующие при данном написании уравнения течению ее слева направо, называются прямыми, а отвечающие течению ее справа налево – обратными.
Критерием химического равновесия является равенство скоростей прямой и обратной реакции:
V1=V2
Согласно закону действия масс скорость V1 прямой реакции выражается равенством:
V1 = К1 [A]a [B]a
а скорость V2 обратной реакции – равенством:
V2 = К2 [С]c[D]d , где
К1 и К2 – соответствующие константы скоростей при данной температуре.
В ходе реакции одновременно с уменьшением концентраций исходных веществ и, следовательно, уменьшении скоростей прямой реакции будет увеличиваться скорость обратной реакции, т.к. увеличиваются концентрации продуктов реакции.
Как только значения V1 и V2 будут одинаковыми, в системе устанавливается динамическое равновесие, и дальнейшее изменение концентраций всех участвующих в реакции веществ прекращается.
Равенство левых частей уравнений 3), 4) требует, чтобы и правые части их были равными между собой.
К1 [A]a[B]a = К2 [С]c[D]d .
Собирая в правую сторону все концентрации компонентов реакции, а в левую – константы скоростей и обозначая отношение констант скоростей
К1/К2=Кс, можно написать
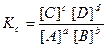
Так как К1 и К2 при данной температуре являются величинами постоянными, то и Кс должна быть при этих условиях тоже величиной постоянной, она называется константой равновесия.
Константа химического равновесия К, единица – лn. моль-n,
где n =1,2,3 – физическая величина, выражающая для данной реакции соотношение между концентрациями исходных веществ и концентрациями продуктов реакции в состоянии химического равновесия.
В зависимости от единицы концентрации и рода химического равновесия символ К имеет различные подстрочные значения – индексы:
Ка – константа, выраженная через активность, Кс – константа, выраженная через молярные концентрации, Кр – константа, выраженная через парциальные давления.
Величина константы зависит от природы реагирующих веществ и температуры, но не зависит от катализатора. Присутствие катализатора в системе лишь ускоряет время наступления равновесия.
Выражение константы равновесия через парциальные давления:
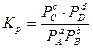

По значению константы равновесия можно судить о полноте протекания реакции.
При К ≥1 равновесие усиливается при почти полном вступлении в реакцию веществ, записанных в левой части уравнения, равновесие «сдвинуть» вправо.
При К ≤ 1 – степень превращения исходных веществ в продукты реакции невелика – равновесие «сдвинуто» влево.
Константа равновесия связана со стандартной энергией Гиббса данной реакции (ΔG0) следующим соотношением:
-ΔG0 = + RT lnKc,
где R – универсальная газовая постоянная (8,31Дж/ моль · К);
T – абсолютная температура, К;
Kc – константа равновесия.
При гетерогенных реакциях в выражении константы равновесия, так же как в выражении закона действия масс для скорости химической реакции, входят концентрации только тех веществ, которые находятся в менее конденсированной фазе.
4.2. Смещение химического равновесия. Принцип Ле-Шателье
При химическом равновесии не происходит изменение количеств веществ в системе, однако это не означает, что химическая реакция не протекает; она идет, но с одинаковыми скоростями в двух противоположных направлениях, Такое равновесие является динамическим.
Если система, находящаяся в равновесии, подвергается внешнему воздействию, то скорость прямой и обратной реакций изменяются по разному. При наступлении равновесия в новых условиях эти скорости также выравниваются, но значения их будут уже другими. В этом случае принято считать, что произошло смещение равновесия.
Направление смещения равновесия можно представить, пользуясь принципом Ле-Шателье, или принципом подвижного равновесия: если на систему, находящуюся в состоянии химического равновесия, оказывается внешнее воздействие (изменяется температура, давление или концентрации), то положение равновесия смещается в ту сторону, которая ослабляет данное воздействие.
В соответствии с принципом Ле-Шателье, нагревание вызывает смещение равновесия в сторону того процесса, протекание которого сопровождается поглощением тепла, иначе говоря, повышение температуры вызывает возрастание константы скорости эндотермического процесса.
Естественно, что понижение температуры, приводит к противоположному результату. Равновесие смещается в сторону того процесса, протекание которого сопровождается выделением тепла, иначе говоря, охлаждение благоприятствует экзотермическому процессу и вызывает рост константы скорости экзотермической реакции.
Например, если в установившемся равновесии:
2SO2(г)+О2(г) 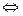 2SO3(г); ΔH=-791,6кДж
2SO3(г); ΔH=-791,6кДж
повышать температуру, то это воздействие сместит равновесие в сторону поглощения теплоты. Таковым является разложение SO3
Влияние давления
Изменение давления вызывает сдвиг равновесия только в том случае, когда количество газообразного вещества меняется до и после реакции.
Влияние давления определяется изменением объема, которое происходит в ходе реакции. Следовательно, при увеличении давления равновесие будет смещаться в сторону образования меньшего количества вещества (молей) газа.
Из этого следует, что в рассматриваемой равновесной системе увеличение давления сместит равновесие в сторону образования SO3.
Если внешнее воздействие на систему проявляется в уменьшении концентрации одного из веществ, участвующих в реакции, то это смещает равновесие в сторону его образования. Наоборот, при увеличении концентрации одного из веществ равновесие смещается в сторону той реакции, в которой это вещество расходуется.
Увеличение концентрации SO2 и O2 (или одновременно) сместит равновесие в сторону образования SO3, как процесса, приводящего к уменьшению концентрации SO2 и O2. Если по мере образования из реакционной среды удаляется SO3, то равновесие тоже сдвинется вправо. Таким образом, если в реакционную смесь ввести избыток одного из исходных веществ, то равновесие смещается в сторону образования продуктов реакции.
Примеры решения задач
Пример 1. В системе А(г)+2В(г) 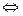 С(г) равновесные концентрации равны
С(г) равновесные концентрации равны
[А]=0,06 моль/ л; [В]=0,12моль/ л; [С]=0,216 моль/ л; найти константу равновесия реакции и исходные концентрации веществ А и В.
Решение:
Константа равновесия данной реакции выражается уравнением:
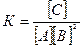
Подставляем в него данные задачи, получаем:
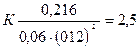
Для нахождения исходных концентраций веществ А и В учтем, что согласно уравнению реакции, из 1 моля А и 2 молей В образуется 1 моль С. По условию задачи в каждом литре системы образовалось 0,216 моля С, следовательно, было израсходовано 0,216 моля А и 0,216 • 2 = 0,432 моля В. Таким образом, искомые исходные концентрации равны:
[А0] = 0,06+0,216= 0,276 моль/ л;
[В0] = 0,12+0,432= 0,552 моль/ л;
Пример 2. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению PCl5 (г) 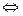 PCl3 (г)+ PCl2 (г); ΔН = +92,59кДж. Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону реакции разложения PCl5
PCl3 (г)+ PCl2 (г); ΔН = +92,59кДж. Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону реакции разложения PCl5
Решение:
а) т.к. реакция разложения PCl5 эндотермическая, то для смещения равновесия в сторону прямой реакции нужно повысить температуру;
б) т.к. в данной системе разложения PCl5 ведет к увеличению объема (из одной молекулы газа образуется две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление;
в) смещение равновесия в указанном направлении можно достигнуть как увеличением концентрации PCl5, так и уменьшением концентрации PCl3 или Cl2.
Пример 3. В сторону какой реакции (прямой или обратной) сместится химическое равновесие обратимой реакции N2 + 3H2 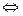 2NH3, если повысить температуру равновесной системы? Прямая реакция - экзотермическая.
2NH3, если повысить температуру равновесной системы? Прямая реакция - экзотермическая.
Решение:
В соответствии с принципом Ле-Шателье, при повышении температуры ускоряется реакция, ослабляющая внешнее воздействие, т.е. обратная реакция, протекающая с поглощением теплоты.
Пример 4. Обратимая реакция протекает по уравнению 2NО + О2 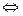 2NО2. В сторону какой реакции (прямой или обратной) сместиться химическое равновесие, если давление увеличить в 2 раза?
2NО2. В сторону какой реакции (прямой или обратной) сместиться химическое равновесие, если давление увеличить в 2 раза?
Решение:
Пусть равновесные концентрации до увеличения давления составляли:
[NO]= a моль/ л,
[O2]= в моль/ л,
[NO2]= с моль/ л,
скорость прямой реакции – V1, скорость обратной реакции – V2.
Тогда V1=К1 а2 в; V1=К2с2.
При увеличении давления в 2 раза:
[NO]=2а моль/ л, [O2]= 2в моль/ л, [NO2]=2с моль/ л; скорости прямой и обратной реакций при новых условиях: V11 = К1 (2а)2 2в = К18а2в;
V21 = K2 (2с)2 = K24с2.
Отсюда:
V11 / V1 = К18а2в / (K1а2в) = 8; V21 / V2 = 4K2C2/ (К2С2) = 4.
Следовательно, при увеличении давления в равновесной системе в 2 раза, скорость прямой реакции возрастает в 8 раз, а скорость обратной реакции в 4 раза, поэтому равновесие сместится вправо – в сторону образования NO2.
Пример 5. При 10000С константа равновесия реакции FeO + CO 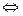 Fe+CO2 равна 0,5. Каковы равновесные концентрации CO и CO2, если начальные концентрации этих веществ составляли: [CO]=0,05 моль/ л, [CO2]=0,01 моль/ л?
Fe+CO2 равна 0,5. Каковы равновесные концентрации CO и CO2, если начальные концентрации этих веществ составляли: [CO]=0,05 моль/ л, [CO2]=0,01 моль/ л?
Решение:
Пусть к моменту равновесия в реакцию вступило Х моль СО. Тогда, согласно уравнению реакции, образовалось Х моль СО2. следовательно, к моменту равновесия: [CO]= (0,05-Х) моль/ л; [CO2] = (0,01+Х) моль/ л.
Отсюда Кр = (0,01+Х) / (0,05-Х). Подставив в этом выражение Кр=0,5, получаем Х= 0,01. Таким образом, искомые равновесные концентрации будут иметь следующие значения: [CO]р = 0,05 – 0,01 = 0,04 моль/ л, [CO2]р = 0,01 + 0,01 = 0,02 моль/ л.
Пример 6. Константы равновесия реакции СО +Н2О 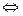 СО2+Н2 при 727 и 9270С соответственно равны 1,4 и 0,74. Как найти ΔG этой реакции и определить ее направление при указанных температурах?
СО2+Н2 при 727 и 9270С соответственно равны 1,4 и 0,74. Как найти ΔG этой реакции и определить ее направление при указанных температурах?
Решение:
ΔG находится из уравнения ΔG= - RT ln K= -19,1•Т•lg K. Температуры 727 и 9270С соответственно равны 1000 и 1200 К.
Тогда: а) ΔG1= - 19,1 · 1000 lg 1,4= -2789 Дж/ моль = - 2,8 кДж/ моль
б) ΔG2= - 19,1 · 1200 lg 0,7= +2502 Дж/ моль = + 2,5 кДж/ моль.
Таким образом, в температурном интервале 727 и 9270С значение ΔG проходит через нуль и направление реакции меняется с прямого на обратное, поэтому реакцию следует проводить при температуре ниже 8000С. С понижением температуры выход будет увеличиваться, однако, время достижения равновесия будет расти.
Пример 7. Известно, что при 2000 К равновесие N2 + O2 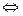 2 NO характеризуется константой Kc=2,3 · 10-4 . Определить равновесную концентрацию окиси азота, если исходные концентрации C1(N2) и C1 (O2) будут по 1 моль/ л.
2 NO характеризуется константой Kc=2,3 · 10-4 . Определить равновесную концентрацию окиси азота, если исходные концентрации C1(N2) и C1 (O2) будут по 1 моль/ л.
Решение:
Согласно уравнению реакции из каждого моля азота образуется 2 моль окиси азота. Следовательно, если обозначить равновесную концентрацию окиси азота C(NO), для достижения её надо затратить C(NO)/2 молей азота и сколько же молей кислорода. Равновесные концентрации можно записать следующим образом:
Cp(O2) = Cp(N2) = 1 – Cp(NO)/2
Запишем выражение константы равновесия равной по условию 2,3 · 10-4
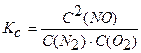
Подставив в него выражение равновесных концентраций, получаем:
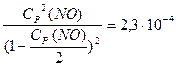
Решая это уравнение относительно Cp(NO), получим 1,52 · 10-2 моль/ л. Следовательно, при температуре 2000 К почти не происходит превращения исходных веществ (N2 и O2) в окись азота.
Пример 8. Как повлияет увеличение давления на химическое равновесие в обратимой системе:
Fe2O3 (k) + 3 H2 (г) 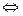 2Fe (k) + 3H2O(г)
2Fe (k) + 3H2O(г)
Решение:
В гетерогенной равновесной системе повышение давления должно привести к смещению равновесия в сторону реакции, приводящей к образованию меньшего количества веществ газов. Так как количество веществ газов, образующихся при протекании прямой и обратной реакции одинаковы, то изменение давления не приведет к смещению равновесия.
 2015-03-07
2015-03-07 2032
2032
