Кроме реакции диссоциации в растворе происходят реакции обмена между протолитом и растворителем (для водных растворов - гидролиз, для неводных – сольволиз). Гидролиз – реакция взаимодействия соли с водой, приводящая к образованию слабого электролита с изменением характера среды.
Гидролизу подвергаются соли, образованные слабым основанием и сильной кислотой и наоборот. Соли, образованные сильным основанием и сильной кислотой гидролизу не подвергаются.
Пример:
1. Взаимодействие соли, образованной слабой кислотой и сильным основанием.
СН3СООNa+ HOH СН3СООH+NaOH
СН3СОО-+ HOH СН3СООH+ OH-, рН>7, среда щелочная
2. Взаимодействие соли, образованной сильной кислотой и слабым основанием.
NH4Cl+HOH NH4OH+HCl
NH4++ HOH NH4OH +H +, рН<7, среда кислая
3. Взаимодействие соли, образованной слабой кислотой и слабым основанием.
СН3СООNH4 СН3СОО-+ NH4+
СН3СОО-+HOH СН3СООH+ OH-
NH4++ HOH NH4OH+ H+
СН3СООNH4+HOH NH4OH+ СН3СООH, рН~7, среда нейтральная.
Механизм гидролиза солей заключается в поляризационном взаимодействии ионов соли с их гидратной оболочкой. Чем сильнее это взаимодействие, тем интенсивнее протекает гидролиз.
Все рассмотренные случаи гидролиза касались солей, образованных однокислотными основаниями и одноосновными кислотами. Соли многоосновных кислот и многокислотных оснований гидролизуются ступенчато, образуя при этом кислые и основные соли.
Например, соли Na2CO3, К3РО4 гидролзуются ступенчато, образуя кислые соли.
Соли AlCl3, Cu(NO3)3, CrCl3 гидролизуются ступенчато с образованием на промежуточных стадиях основных солей.
Процесс гидролиза характеризуется константой гидролиза (Кгидр) и степенью гидролиза (α). Константа гидролиза отвечает за глубину протекания процесса.
Рассмотрим взаимодействие хлорида аммония с водой:
NH4Cl+H2O NH4OH+HCl
NH4++ H2O NH4OH+H+, рН<7, среда кислая
Запишем константу равновесия, характеризующую процесс взаимодействия хлорида аммония с водой:
Кравн =[NH4OH][H+] = Кгидр
[NH4+][H2O]
Степень гидролиза представляет собой отношение концентраций гиролизуемой соли к общей концентрации соли и выражают в долях единицы или в процентах:
α = 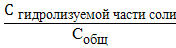
Степень гидролиза зависит от природы соли, ее концентрации и температуры. Согласно закону действующих масс, степень гидролиза возрастает с разбавлением раствора. Качественно влияние температуры на степень гидролиза можно прогнозировать на основе принципа Ле Шателье. Так, реакция экзотермична (∆Н0=-56,5 кДж /моль), то противоположный ей процесс гидролиза является эндотермическим. Поэтому в соответствии с принципом Ле Шателье с повышением температуры степень гидролиза растет.
Гидролиз характерен для многих классов неорганических и органических соединений. Гидролиз неорганических соединений важен для оценки их токсичности, а гидролиз органических соединений применяют для получения ценных продуктов из древесины, жиров, эфиров и т.п., но особенно важную роль гидролиз играет в жизнедеятельности живых организмов.
Роль гидролиза в биохимических процессах трудно переоценить. Прежде всего, необходимо отметить ферментативный гидролиз, благодаря которому, три основных компонента пищи - жиры, белки, углеводы - в желудочно-кишечном тракте расщепляются водой на более мелкие фрагменты. В общем виде гидролиз пищевых компонентов описывается
R1-O-R2+H2O→ R1-OH + R2-OH
где R1, R2 – фрагменты биоорганической молекулы, связанные через кислород.
Без этого процесса не было бы возможно усвоение пищевых продуктов, так как всасываться в кишечнике способны только относительно небольшие молекулы. Так, например, усвоение полисахаридов и дисахаридов становится возможным лишь после полного их гидролиза ферментами до моносахаридов. Точно так же белки и липиды гидролизуются до веществ, которые лишь потом могут усваиваться.
 2015-04-01
2015-04-01 1250
1250
