Закон Максвелла описывается некоторой функцией f (v), называемой функцией распределения молекул по скоростям. Если разбить диапазон скоростей молекул на малые интервалы, равные d v, то на каждый интервал скорости будет приходиться некоторое число молекул d N(v), имеющих скорость, заключенную в этом интервале. Функция f(v) определяет относительное число молекул d N(v)/N, скорости которых лежат в интервале от v до v+ d v, т. е. 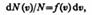 откуда
откуда 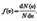 Применяя методы теории вероятностей. Максвелл нашел функцию f(v) — закон о распределеня молекул идеального газа по скоростям:
Применяя методы теории вероятностей. Максвелл нашел функцию f(v) — закон о распределеня молекул идеального газа по скоростям: 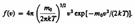 Из (44.1) видно, что конкретный вид функции зависит от рода газа (от массы молекулы) и от параметра состояния (от температуры Т).
Из (44.1) видно, что конкретный вид функции зависит от рода газа (от массы молекулы) и от параметра состояния (от температуры Т).
График функции (44.1) приведен на рис.. Так как при возрастании v множитель exp[ –m 0 v2/(2kT) ] уменьшается быстрее, чем растет множитель v 2, то функция f(v), начинаясь от нуля, достигает максимума при v B, и затем асимптотически стремится к нулю. Кривая несимметрична относительно v B.

Относительное число молекул dN(v)/N, скорости которых лежат в интервале от v до v+ d v, находится как площадь заштрихованной полоски на рис. 65. Площадь, ограниченная кривой распределения и осью абсцисс, равна единице. Это означает, что функция f(v) удовлетворяет условию нормировки
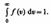
Скорость, при которой функция распределения молекул идеального газа по скоростям максимальна, называется наиболее вероятной скоростью. Значение наиболее вероятной скорости можно найти продифференцировав выражение (44.1) (постоянные множители опускаем) по аргументу v, приравняв результат нулю и используя условие для максимума выражения f(v): 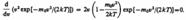 Значения v= 0 и v =¥ соответствуют минимумам выражения (44.1), а значение v, при котором выражение в скобках становится равным нулю, и есть искомая наиболее вероятная скорость v B:
Значения v= 0 и v =¥ соответствуют минимумам выражения (44.1), а значение v, при котором выражение в скобках становится равным нулю, и есть искомая наиболее вероятная скорость v B:
№38 Газ в поле тяжести. Барометрическая формула. Распределение Больцмана по энергиям.
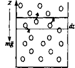 Рассмотрим столб газа сечением S, находящийся при постоянной температуре в поле силы тяжести. Выделим слой газа толщиной dz на высоте z и вычислим давление газа на его основания. Давление слоя газа на верхнее и нижнее основания слоя разное — оно различается в результате действия силы тяжести. Очевидно, разность давлений равна весу газа, заключенного в слое, отнесенному к единице площади основания столба.
Рассмотрим столб газа сечением S, находящийся при постоянной температуре в поле силы тяжести. Выделим слой газа толщиной dz на высоте z и вычислим давление газа на его основания. Давление слоя газа на верхнее и нижнее основания слоя разное — оно различается в результате действия силы тяжести. Очевидно, разность давлений равна весу газа, заключенного в слое, отнесенному к единице площади основания столба.
Пусть разность давлений есть dP. Давление газа с ростом высоты уменьшается, поэтому dP равно весу слоя со знаком минус. Вес газа в объеме слоя dV = dz · S равен ρ· g · dV, где ρ — плотность газа, g — ускорение силы тяжести. Таким образом,
dP = ‑ρ·g·dV/S = ‑ρ·g·dz.
По определению 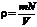 . Выразим отношение N / V с помощью уравнения состояния (2.7), после чего находим:
. Выразим отношение N / V с помощью уравнения состояния (2.7), после чего находим:
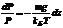 . Интегрируя это соотношение, получим
. Интегрируя это соотношение, получим 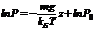 , где P0 — константа, определяемая пределами интегрирования. Окончательно имеем:
, где P0 — константа, определяемая пределами интегрирования. Окончательно имеем: 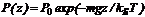 (2.9)
(2.9)
Здесь P0 — давление при z = 0. т. е. у основания столба. Аналогично с высотой изменяется и плотность частиц 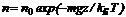 (2.10)Давление и плотность газа распределены по объему газа неоднородно, они принимают максимальные значения у основания столба и убывают с высотой.
(2.10)Давление и плотность газа распределены по объему газа неоднородно, они принимают максимальные значения у основания столба и убывают с высотой.
Величина, входящая в показатель экспоненты в формулах (2.9) и (2.10), есть потенциальная энергия частицы в поле тяжести U = mgz -Таким образом, распределение молекул в произвольном потенциальном внешнем поле, в котором частицы обладают потенциальной энергией U (r), может быть описано формулой: 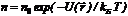 (2.11).
(2.11).
Эта формула называется распределением Больцмана. Здесь n0 — плотность частиц в точках пространства, для которых потенциальная энергия принята равной нулю.
Согласно распределению Больцмана число частиц, обладающих определенными значениями потенциальной энергии определяется отношением величины потенциальной энергии U к тепловой энергии частицы kБT. Чем больше энергия теплового движения, тем более разупорядочена система частиц, значит, тем более однородно распределены частицы в пространстве. В самом деле, если kБT >> U, 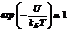 , и из формулы (2.11) следует, что n = n0 при любом значении U. В случае kБT << U распределение частиц максимально упорядочено: плотность частиц максимальная состоянии с минимальной потенциальной энергией Umin, в то время как плотность частиц в других состояниях равна нулю.
, и из формулы (2.11) следует, что n = n0 при любом значении U. В случае kБT << U распределение частиц максимально упорядочено: плотность частиц максимальная состоянии с минимальной потенциальной энергией Umin, в то время как плотность частиц в других состояниях равна нулю.
Барометрическая формула
Для идеального газа, имеющего постоянную
температуру T и находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного падения g одинаково), барометрическая формула имеет следующий вид:
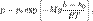
где p — давление газа в слое, расположенном на высоте h, p 0 — давление на нулевом уровне (h = h 0), M — молярная масса газа, R — газовая постоянная, T — абсолютная температура. Из барометрической формулы следует, что концентрация молекул n (или плотность газа) убывает с высотой по тому же закону:
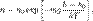
где m — масса молекулы газа, k — постоянная Больцмана.
Распределение Больцмана по энергиям Это распределение по энергиям частиц (атомов, молекул) идеального газа в условиях термодинамического равновесия. Распределение Больцмана было открыто в 1868 - 1871 гг. австралийским физиком Л. Больцманом. Согласно распределению, число частиц ni с полной энергией Ei равно:ni =A•ωi •eEi /Kt (1)
где ωi - статистический вес (число возможных состояний частицы с энергией ei). Постоянная А находится из условия, что сумма ni по всем возможным значениям i равна заданному полному числу частиц N в системе (условие нормировки): 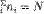 В случае, когда движение частиц подчиняется классической механике, энергию Ei можно считать состоящей из кинетической энергии Eiкин частицы (молекулы или атома), её внутренней энергии Eiвн (напр., энергии возбуждения электронов) и потенциальной энергии Ei,пот во внешнем поле, зависящей от положения частицы в пространстве:
В случае, когда движение частиц подчиняется классической механике, энергию Ei можно считать состоящей из кинетической энергии Eiкин частицы (молекулы или атома), её внутренней энергии Eiвн (напр., энергии возбуждения электронов) и потенциальной энергии Ei,пот во внешнем поле, зависящей от положения частицы в пространстве:
Ei = Ei, кин + E i, вн + Ei, пот (2)
Распределение частиц по скоростям является частным случаем распределения Больцмана. Оно имеет место, когда можно пренебречь внутренней энергией возбуждения
Ei,вн и влиянием внешних полей Ei,пот. В соответствии с (2) формулу (1) можно представить в виде произведения трёх экспонент, каждая из которых даёт распределение частиц по одному виду энергии.
В постоянном поле тяжести, создающем ускорение g, для частиц атмосферных газов вблизи поверхности Земли (или др. планет) потенциальная энергия пропорциональна их массе m и высоте H над поверхностью, т.е. Ei, пот = mgH. После подстановки этого значения в распределение Больцмана и суммирования по всевозможным значениям кинетической и внутренней энергий частиц получается барометрическая формула, выражающая закон уменьшения плотности атмосферы с высотой.
В астрофизике, особенно в теории звёздных спектров, распределение Больцмана часто используется для определения относительной заселённости электронами различных уровней энергии атомов. Если обозначить индексами 1 и 2 два энергетических состояния атома, то из распределения следует:
n2/n1 = (ω2/ω1)•e-(E2-E1)/kT (3) (ф-ла Больцмана).
Разность энергий E2-E1 для двух нижних уровней энергии атома водорода >10 эВ, а значение kT, характеризующее энергию теплового движения частиц для атмосфер звёзд типа Солнца, составляет всего лишь 0,3-1 эВ. Поэтому водород в таких звёздных атмосферах находится в невозбуждённом состоянии. Так, в атмосферах звёзд, имеющих эффективную температуру Тэ > 5700 К (Солнце и др. звёзды), отношение чисел атомов водорода во втором и основном состояниях равно 4,2•10-9.
Распределение Больцмана было получено в рамках классической статистики. В 1924-26 гг. была создана квантовая статистика. Она привела к открытию распределений Бозе - Эйнштейна (для частиц с целым спином) и Ферми - Дирака (для частиц с полуцелым спином). Оба эти распределения переходят в распределение, когда среднее число доступных для системы квантовых состояний значительно превышает число частиц в системе, т. о. когда на одну частицу приходится много квантовых состояний или, др. словами, когда степень заполнения квантовых состояний мала. Условие применимости распределении Больцмана можно записать в виде неравенства:
№39 Термодинамический метод изучения макросистем. Основные понятия термодинамики. Внутренняя энергия, работа, количество теплоты.
Термодинамический подход. Систему рассматривают без учета её внутренней структуры. При этом используют понятия и величины, относящиеся к системе в целом. Например, идеальный газ в состоянии равновесия характеризуют объёмом, давлением и температурой (V, P и T). Экспериментально устанавливают связь между этими величинами. Для термодинамического подхода характерно использование термодинамических потенциалов для описания систем, находящихся в равновесном или слабо неравновесном состоянии. Для сильно неравновесных нелинейных систем описание состояния через потенциалы невозможно.
 2015-05-18
2015-05-18 1513
1513
