1.1. Типы химической связи
Тип связи, возникающий между элементарными частицами в материалах, определяется электронным строением атомов, вступающих во взаимодействие. При сближении элементарных частиц на определённое расстояние, благодаря электромагнитному взаимодействию электронных оболочек и ядер атомов возникают силы взаимного притяжения или силы взаимного отталкивания. Эти силы заметно действуют лишь на очень коротких расстояниях,не превышающих один нанометр (10-9 м).
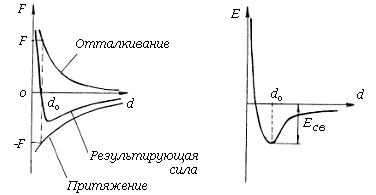
Зависимость сил притяжения Fпр и отталкивания Fот от расстояния d между атомами показана на рис. 1.1.
а) б)
Рис. 1.1. Изменение силы взаимодействия (а) и энергии связи (б) при сближении атомов в кристалле
Силы притяжения возникают благодаря взаимодействию электронов с положительно заряженным ядром собственного атома, а так же с положительно заряженными ядрами соседних атомов. Силы отталкивания возникают в результате взаимоотталкивания положительно заряженных ядер соседних атомов при их сближении. Независимо от природы этих сил общий характер изменения Fпр и Fот остаётся одинаковым. На относительно больших расстояниях между атомами возникают силы притяжения Fпр, увеличивающиеся с уменьшением расстояния d между частицами (кривая1). На небольших расстояниях возникают силы отталкивания, причём с уменьшением d эти силы растут значительно быстрее, чем Fпр. При определённом расстоянии d=d0, когда Fпр=Fот, результирующая сила взаимодействия Fр обращается в нуль. При значениях d>d0 равнодействующая двух сил Fр отрицательна, то есть она стремится сблизить атомы; при d<d0 - положительна, то есть она препятствует дальнейшему сближению частиц. Так как F= - ¶U/¶d (U - энергия взаимодействия частиц), то при d=d0 значение энергии взаимодействия достигает минимального значения, и атомы будут находиться в состоянии устойчивого равновесия.
Силы, действующие между атомами, способны совершать работу, то есть система из двух или более атомов обладает потенциальной энергией. Смещение частиц в любую сторону от d0 увеличивает их потенциальную энергию, так возникают силы, стремящиеся вернуть их в исходное устойчивое положение. Следовательно, точка do соответствует минимуму потенциальной энергии Uп.min. Зависимость потенциальной энергии Эп двух атомов от расстояния между ними показана на рис.1.1(б). Из графика следует, что для удаления атомов друг от друга на достаточно большое расстояние нужно затратить работу, равную или превышающую значение Эп.min..
Абсолютное значение Эп.min. называется энергией химической связи Uсв. Она определяет температуры плавления, испарения, модуль упругости, температурный коэффициент линейного расширения и др. Энергию химической связи принято измерять в электронвольтах (эВ). Один электронвольт равен работе, которая совершается электрическим полем с разностью потенциалов в 1В для ускорения одного электрона (1эВ=1.6*10-19 Дж).
В образовании химических связей между атомами в молекулах или в кристаллах принимают участие, главным образом, электроны внешних оболочек атомов, или валентные электроны. Валентность атома определяется числом этих электронов.
Условием для образования химической связи является уменьшение общей потенциальной энергии атомов, образующих химическое соединение или кристаллическое тело. При соединении атомов энергия кристаллической решётки будет меньше, чем сумма энергий, входящих в её состав атомов.
По характеру взаимодействия химические связи разделяются на четыре основных типа: ионную (гетерополярную), ковалентную (гомеополярную), металлическую и молекулярную. Тип химической связи определяет вид кристаллов: ионные, ковалентные, металлические и молекулярные кристаллы.
Ионная (гетерополярная) связь. Ионная связь наблюдается в химических соединениях атомов металлов с металлоидными атомами. Образование связи происходит путём передачи атомом одного элемента своего валентного электрона атому другого элемента.
Электроположительный элемент (металл) теряет валентные электроны, превращаясь в положительный ион (катион), а электроотрицательный (металлоид) приобретает его, превращаясь в отрицательный ион (анион), достраивая тем самым свою валентную зону до устойчивой конфигурации, как у инертных газов. Таким образом, в узлах ионных кристаллов располагаются положительно и отрицательно заряженные ионы. Эти ионы взаимодействуют по закону Кулона, как два разноимённых заряда. Важной особенностью ионной связи является её поляризуемость, вызванная поляризуемостью ионов, обусловленной не совпадением центров тяжести отрицательных и положительных зарядов ионов. Поляризуемость характерезуется дипольным моментом М, который определяется выражением
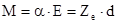 , (1.1)
, (1.1)
где a - коэффициент пропорциональности, называемый поляризуемостью;Е - напряжённость электрического поля, возникающая при смещении зарядов; Zе - заряд; d - дипольное расстояние между центрами положительного и отрицательного зарядов иона.
Энергия притяжения ионов, отстоящих друг от друга на расстояние d, определяется следующей формулой
Uпр= -q2/(4 πεod), (1.2)
где q - заряд ионов; εо - электрическая постоянная..
При сближении ионов на достаточное расстояние, между ними возникает отталкивание с энергией Uот=B/dn, где В и n - постоянные. Результирующая энергия химического взаимодействия между парами ионов равна
Uсв=Uот+Uпр=B/dn-q2/(4 πεod). (1.3)
Равновесное состояние между ионами устанавливается при равенстве сил притяжения и отталкивания Fпр=Fот, когда d=do. Используя значения Fпр=(¶Uпр./¶d)d=do и
Fот= - (¶Uот./¶d)d=do выражение (1.2) приводится к виду
Uсв= -(q2/4 πεodo)(1-1/n). (1.4)
Тогда для решётки, построенной из N пар ионов, энергия связи равна
Uсв.реш.= -NA(q2/4 πεoro)(1-1/n), (1.5)
где А - постоянная Моделунга, учитывающая тот факт, что взаимодействие происходит не только с ближайшими ионами, но и со всеми ионами решётки.
Число ближайших соседей противоположного знака, окружающих ион в кристаллической решётке, называют координационным числом К. Оно зависит от соотношения радиусов металлического RM и неметаллического RНМ радиуса ионов (табл. 1.1).
Таблица 1.1
| К | ||||
| RM/Rнм | 1-0.73 | 0.73-0.41 | 0.41-0.22 | 0.22 |
Ионная связь является сильной связью с энергией, достигающей сотни и тысячи килоджоулей на моль. Поэтому твёрдые тела с ионной связью характерезуются повышенной механической прочностью и твёрдостью, относительно высокой температурой плавления и испарения, низким коэффициентом линейного расширения. Электропроводимость их имеет ионный характер и сильно зависит от температуры. При обычных температурах материалы с ионной связью являются диэлектриками.
Ковалентная связь. Ковалентная связь образуется между атомами одного или нескольких химических элементов (электроотрицательных) с близкими ионизационными потенциалами. Ковалентная связь осуществляется парой валентных электронов с противоположно направленными спинами, которые принадлежат различным атомам. Орбиты валентных электронов, участвующих в образовании связей, перекрываются и чем больше перекрытие, тем прочнее связь. Электроны, участвующие в связи, являются общими для пар атомов (рис. 1.2).
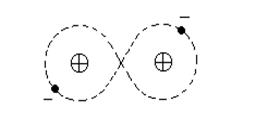
Рис. 1.2. Схематическое изображение двухатомной молекулы водорода с ковалентной связью
Обобществление электронов сопровождается перераспределением электронной плотности, которая получается наибольшей между положительно заряженными ионами. Появление состояния с повышенной плотностью электронного облака вызывает всегда уменьшение энергии системы и приводит к возникновению сил притяжения между атомами.
Ковалентная связь является насыщеной, то есть атом данного элемента может образовать ограниченное число ковалентных связей, не превышающее число неспаренных электронов во внешней электронной оболочке. Это число и определяет максимальную валентность атома. Так, например, атом углерода, расположенный в IV группе периодической системы Менделеева, имеет четыре атома с нескомпенсированными спинами. Его максимальная валентность 4 и он может образовать четыре ковалентных связи.
Ковалентная связь пространственно направлена, то есть плотность электронного облака по линии, связывающей два соседних атома, значительно выше, чем по другим направлениям. Ковалентная связь характерна как для неорганических, так и органических веществ.
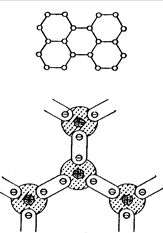
В неорганических веществах она возникает между атомами элементов IV, V, VI, VII групп периодической системы. Эти элементы кристаллизуются по правилу 8-N, где N - номер группы, к которой принадлежит элемент. Исходя из этого правила, в кристаллах каждый атом окружён 8-N ближайшими соседями. Например, алмаз, кремний, германий, принадлежащие к IV группе, окружены четырмя ближайшими соседями и имеют тетраэдрическую пространственную координацию. Фосфор, мышьяк, сурьма расположены в V группе, поэтому каждый атом имеет три ближайших соседа (рис. 1.3 б). Эти элементы образуют слоистую решётку, причём слои связаны друг с другом слабыми связями Ван-дер-Ваальса.
Ввиду высокой прочности (до 450 кДж/моль) и направленности ковалентной связи неорганические ковалентные кристаллы весьма прочны и тверды, имеют высокие точки плавления и теплоты сублимации, обладают небольшими коэффициентами термического расширения, но они хрупки и легко разрушаются под действием ударов. В электрическом отношении они являются диэлектриками.
Рассмотренные выше элементы: кремний, германий, фосфор, сурьма, мышьяк, алмаз и другие с ковалентными внутрикристаллическими связями обладают полупроводниковыми свойствакми и применяются как полупроводники при изготовлении различных активных элементов: диодов, транзисторов, интегральных схем и других.
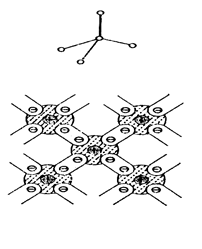 |  |
а) б)
Рис. 1.3. Схематическое изображение структуры кристаллов с ковалентной связью: а - элементов группы IV (С, Si, Ge); б - элементов группы V(P,As,Sb)
В органических соединениях ковалентной связью соединены атомы внутри молекул. При этом в структурных формулах молекул одинарная ковалентная связь обозначается одной чёрточкой, двойная - двумя чёрточками, а тройная - тремя:
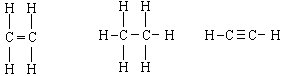
этилен этан ацетилен
Так как при образовании молекул насыщаются электронные оболочки атомов, то молекулы между собой не могут соединяться ковалентной связью, и поэтому молекулы связаны между собой значительно слабее, чем внутри.
При объединении в молекулу различных атомов, электронная пара, образующая ковалентную связь, может в большей или меньшей степени сместиться к каким-либо атомам молекулы. Это обусловлено неодинаковой способностью различных атомов присоединять к себе электроны. Она особенно велика у атомов, которым не хватает 1-3 электронов для заполнения внешней электронной оболочки и образования системы с конфигурацией электронов, подобной инертным газам. К таким атомам смещаются электроны, образующие связь, и около них концентрируются отрицательные заряды молекулы. Ввиду этого суммарный электрический момент m отличен от нуля (m≠ 0) и молекулы в этом случае называются полярными (например молекула Н2О). Если же центры положительных и отрицательных зарядов совпадают, то электрический момент равен нулю (m= 0) и молекулы называются неполярными (например молекула С2Н4).
Металлическая связь. Металлическая связь образуется между атомами одного или некольких элементов (электроположительных), у которых на внешних оболочках имеется меньше половины электронов. В таких атомах внешние валентные электроны связаны с ядром относительно слабо. В процессе образования твёрдого состояния атомы распологаются настолько близко друг к другу, что валентные электроны могут переходить от атома к атому, то есть свободно перемещаться внутри кристаллической решётки. По сути, образуются положительные ионы и движущиеся между ними относительно свободно электроны, то есть электронный газ. Такое обобществленние электронов обусловливает однородное распределение электронной плотности в кристаллической решётке металлов.
Металлическая связь возникает в результате силового воздействия положительных ионов решётки и электронного газа: электроны в металле "стягивают" положительные ионы, уравновешивая силы отталкивания, действующие между самими ионами. При этом устойчивость решётки будет наибольшей. Энергия металлической связи имеет величину порядка 100 - 1000 кДж/моль.
Ввиду высокой подвижности обобщённых электронов металлическая связь не локализована, она отличается пространственной ненаправленностью и ненасыщена. Вследствие этого при механическом воздействии на металл положительные ионы могут взаимно перемещаться, не нарушая связи между электронным газом. Поэтому для металлов характерна высокая пластичность - способность испытывать значительные остаточные деформации без нарушения сплошности тела. Наличие свободных электронов, относительно свободно перемещающихся внутри всей решётки, обусловливают высокую электро- и теплопроводность металлов, непрозрачность и высокую отражательную способность их в широком диапазоне частот.
Молекулярная связь (связь Ван-дер-Ваальса). Молекулярная связь (связь Ван-дер-Ваальса) образуется при взаимном сближении молекул различных веществ (парафин, жидкие кристаллы, полимеры и др.) с ковалентным характером внутримолекулярного взаимодействия или атомов инертных газов. Как правило, эти связи намного слабее внутримолекулярных, однако они определяют ряд важных свойств, в частности температуру плавления, температурный коэффициент линейного расширения.
В основе молекулярной связи лежит поляризация молекул, образующих структуру вещества. Поляризация и дипольный момент, возникающий вследствии того, что при тепловых колебаниях атомов, образующих молекулы, центры тяжести положительно заряженных ядер и отрицательно заряженных электронов, имеющих разную массу, а следовательно и инерцию, оказываются смещёнными относительно друг друга. Дипольный момент при этом флюктуирует с частотой.
Энергия связи сил Ван-дер-Ваальса невелика и составляет 1-8 кДж/моль. Поэтому структуры, обусловленные этой связью, не устойчивы, легко летучи и имеют низкие температуры плавления. Наиболее слаба связь между неполярными молекулами. Если молекулярный вес не очень велик, то такие вещества при комнатных температурах являются газами или жидкостями.
Вещества с молекулярной структурой не содержат ни свободных электронов, ни ионов, и поэтому они являются диэлектриками.
Для полимеров малая энергия связи между молекулами определяет большие температурные коэффициенты расширения.
На рис. 1.4 схематически представлены рассмотренные типы химических связей (ионной, ковалентной, металлической, молекулярной) в кристаллах твёрдых веществ: поваренной соли (NaCl), алмаза (С), меди (Cu) и нейтрального газа - аргона (Ar).
Мы рассмотрели типы химических сязей в идеальных веществах, но необходимо отметить, что в реальных материалах каждая из рассмотренных химических связей в чистом виде почти никогда не встречается, всегда имеет место наложение двух и более типов связей. Но одна из них имеет превалирующее значение и определяет структуру и свойства материала.
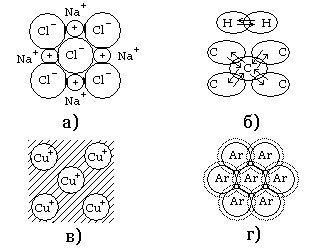
Рис. 1.4. Схема, иллюстрирующая основные типы химической связи в кристаллах: а - ионная связь (хлористый натрий); б - ковалентная связь (алмаз); в - металлическая связь (медь; заштрихованная область - электронный газ); г - молекулярная связь (аргон)
1.2. Строение кристаллов
Для характеристики структуры кристаллических тел вводится понятие об элементарной кристаллической ячейке, то есть о таком минимально-пространственном элементе структуры, который содержит все её частицы и полностью отражает симметрию решётки. Элементарная ячейка представляет собой параллелепипед (рис 1.5), который характеризуется 6 параметрами: тремя линейными параметрами а, b,с и тремя углами между ними a, b, g.
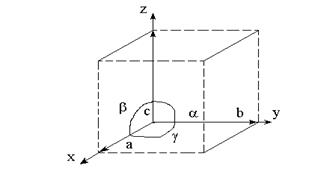
Рис. 1.5. Элеменарная ячейка кристалла
Размеры ребер а, b, c определяют расстояние между центрами соседних частиц и называются параметрами решетки. Соотношения между размерами ребер и углов между ними определяют форму элементарной ячейки. По форме элементарных ячеек все кристаллы подразделяют на семь систем (табл. 1.2), образующих 14 различных кристаллических решёток (решёток Браве).
Таблица 1.2
Кристаллические системы элементов
| Система | Рёбра | Углы |
| 1.Триклинная | a¹b¹c | a¹b¹g |
| 2.Моноклинная | a¹b¹c | a=b=900; g¹900 |
| 3.Ромбическая | a¹b¹c | a=b=g=90 0 |
| 4.Ромбоэдрическая | a=b=c | a=b=g¹90 0 |
| 5.Гексагональная | a=b¹c | a=b=90 0; g=120 0 |
| 6.Тетрагональная | a=b¹c | a=b=g=90 0 |
| 7.Кубическая | a=b=c | a=b=g=90 0 |
В ряде случаев для полного выражения симметрии кристаллической решётки, элементарные ячейки строят таким образом, что они содержат атомы не только в вершинах, но и в других точках. На рис. 1.6 представлена схема расположения частиц в элементарных ячейках кубической и гексагональной систем, в которых наиболее часто кристаллизуются металлы.
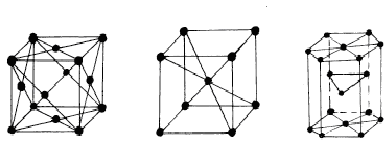
а) б) в)
Рис. 1.6. Типы элементарных ячеек кристаллических решёток: а – гранецентрированная кубическая (ГЦК); б – обьемноцентрированная кубическая (ОЦК); в - гексагональная плотноупакованная (ГПУ)
Объёмноцентрированная кубическая решётка (ОЦК) содержит дополнительный атом в центре куба. В ОЦК кристаллизуются металлы Fea, W, Tib, V, Mg, Cr, Li, Na, K и другие. Кубическа гранецентрированная решётка (ГЦК) содержит дополнительно по одному атому в плоскости каждой грани. ГЦК является основой металлов: Fe, Co, Al, Ni, Cu, Ag, Au, Pt, Pb, редкоземельных и других элементов. В гексагональной решётке дополнительный атом расположен в центре противоположных шестигранных оснований призмы и три атома - в средней плоскости призмы. Такую структуру имеют атомы: Be, Mg, Ti, Cd, Zn и другие. Для дополнительной характеристики кристаллических решёток используют координационное число и коэффициент компактности. Координационное число (К) - это число атомов, находящихся на равном и наименьшем расстоянии от данного атома. Чем выше координационное число, тем больше плотность упаковки. В простой кубической решётке число ближайших соседей равно 6 (К6), для объёмноцентрированной кубической решётки число ближайших атомов равно 8 (К8), а для ГЦК-12 (К12).
Коэффициент компактности определяет отношение объёма всех элементарных частиц, приходящихся на одну элементарную ячейку, ко всему объёму элементарной ячейки. Для простой кубической решётки коэффициент компактности равен 0,52, для ОЦК - 0,68 и ГЦК - 0.74.
Не всякую элементарную решётку можно получить трансляцией одного атома. Путём трансляции элементарной ячейки на расстояние, меньше периода решётки, получается, так называемая, решётка с базисом (рис. 1.7, a). Такую решётку можно представить в виде вставленных друг в друга решёток, каждая из которых определяется векторами а и b.
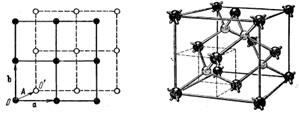
а) б)
Рис. 1.7. Решётка с базисом: а - двухмерная решётка с базисом; б-объемная решётка с базисом (решётка типа алмаза) с изображением тетраэдрических ковалентных связей атомов
Смещение решёток относительно друг друга описывается вектором А, называемым базисным.
На рис. 1.7, б показан пример трёхмерной решётки типа алмаза, в которую кристаллизуются углерод, кремний, германий, арсенид галлия и другие.
Эта решётка получается путём трансляции ГЦК ячейки на расстояние 1/4 пространственной диагонали. Базис этой решётки содержит два атома с координатами (0;0;0) и (1/4;1/4;1/4). Каждый атом углерода окружён четырьмя ближайшими соседями, связь между ними - ковалентная. Положение и ориентация кристаллических решёток определяется индексами узлов, направлений и плоскостей - индексами Миллера.
Положение узлов элементарной ячейки определяется системой трёх координат x,y,z. Эти координаты можно выразить так: x=m∙a, y=n·b, z=p·c, где m, n, p - целые числа. Если за единицы измерения длин принять постоянные решётки а, b, с, то координатами узла будут числа m, n, p, которые называют индексами узла и записывают [[m, n, p]] (рис. 1.8, a).
Для определения направлений в кристалле строится линия, проходящая через начало координат и первый узел данного направления. Её направление однозначно определяется индексом первого узла и обозначается числами, заключёнными в квадратные скобки [m n p]. Поэтому индексы узла одновременно являются индексами данного направления и всех параллельных ему направлений. Индексы направлений осей кубической решётки x-[1 0 0], y-[0 1 0] и z-[0 0 1]; индекс пространственной диагонали [1 1 1]. Индексы направлений всегда выражают целыми числами, а отрицательное значение индекса обозначается знаком минус над индексом (рис. 1.8, a).
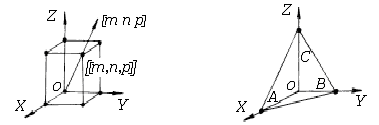
а) б)
Рис. 1.8. Обозначение узлов и направлений (а), и плоскостей (б) в кристалле
Положение плоскости в пространстве определяется отрезками, отсекаемыми плоскостью по осям x, y, z. Индексы плоскоти находятся следующим образом.
1. Находят точки A, B, C (рис. 1.8, б), в которых данная плоскость пересекает основные координатные оси и записывают их координаты в единицах постоянной решётки А=m, B=n, C=p, где m, n, p - целые числа (координаты узлов).
2. Записывают величины, обратные этим отрезкам, 1/m, 1/n, 1/p, и приводят к наименьшему целому d, кратному каждому из чисел m, n, p. В этом случае индексами плоскости являются числа h=d/m, k=d/n, l=d/p, которые заключаются в круглые скобки (h k l). Например, для плоскости, которая пересекает оси x, y и z в точках с координатами 4, 1 и 2 находим d=4 и, следовательно, индексы Миллера для этой плоскости есть (1 4 2).
Если плоскость пересекает координатную ось в бесонечности, то соответствующий индекс Миллера равен нулю. Если плоскость пересекает ось в области отрицательных значений координат, то над соответствующим индексом ставится знак минус. На рис. 1.9 представлены обозначения основных плоскостей в кубической решётке.

а) б) в)
Рис. 1.9. Индексы основных плоскостей в кубической решётке: а –плоскость (100); б - плоскость (110); в - плоскость (111).
1.3. Дефекты кристаллических тел
Строение реальных кристаллов отличается от идеальных. В реальных кристаллических материалах всегда содержатся дефекты, образующиеся уже в процессе кристаллизации вещества и которые оказывают сильное влияние на электрические, механические, оптические и другие свойства. Дефекты кристаллов подразделяют на точечные и линейные.
К точечным дефектам относятся чужеродные атомы внедрения и вакансии.
Атомы внедрения могут располагаться в промежутках между атомами кристалла (рис. 1.10, а) или замещать часть атомов основного вещества в узлах кристаллической решётки (рис. 1.10, б).
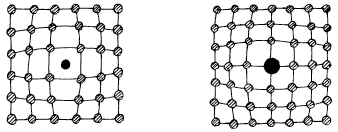
а) б)
Рис. 1.10. Искажение кристаллической решетки при наличии атомов внедрения (а) и замещения (б)
Так как чужеродные атомы по своим размерам и силовым полям отличаются от атомов основного кристалла, то их наличие вызывает искажения решётки, как изображено на рис. 1.10.
Вакансией называют пустой узел кристаллической решётки. В кристалле всегда имеются атомы, кинетическая энергия которых значительно выше средней, соответствующей данной температуре. Атомы, обладающие в данный момент достаточно высокой энергией, могут не только совершать колебания движения около положения равновесия, но и удаляться на значительные расстояния от положения равновесия, преодолевая потенциальный барьер, созданный соседними атомами. Этот поцесс сопровождается образованием пары - вакансия и атом внедрения (дефекты по Френкелю, рис. 1.11, а). При образовании дефектов по Френкелю атому, переходящему из узла в междоузлие, необходимо не только разрывать связи с соседними атомами, но и раздвигать их, внедряясь между ними. Это требует значительной затраты энергии. Эти дефекты образуются при интенсивном внешнем энергетическом воздействии (облучение нейтронами, a-частицы и так далее) и может происходить в кристаллах, состоящих из атомов двух сортов, сильно различающихся своими размерами.
Если какой-либо атом покидает своё место в узле решётки и выходит на поверхность кристалла, то в этом случае в поверхностном слое появляется одиночная вакансия (дефекты по Шоттки, рис. 1.11, б). Путём замещения глубже лежащим атомом вакансия втягивается внутрь кристалла. Такое образование вакансий не сопровождается одновременным внедрением атомов в междоузлие.Oбычно дефекты по Шоттки образуются самопроизвольно в заметной концентрации при достаточном нагреве любого кристалла.
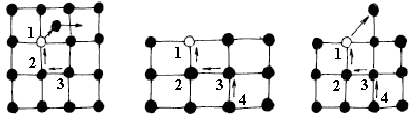
а) б)
Рис. 1.11. Дефекты по Френкелю (а) и по Шоттки (б)
Источником такого рода вакансии могут быть различные несовершенства кристаллов: границы зёрен, недостроенные атомные плоскости, микроскопические трещины и так далее.
Равновесная концентрация дефектов в кристалле зависит,прежде всего, от температуры, потому что с увеличением температуры растёт число атомов, энергия которых оказывается достаточной для преодоления силы связи с соседними атомами и образования дефекта. На основании закона Больцмана число таких атомов пропорционально выражению exp(-U/kT), где Т - абсолютная температура; k - постоянная Больцмана; U - энергия образования дефекта. Количество дефектов по Френкелю в кристалле, содержащем N узлов, определяется по формуле
Nф=ANe-Uф/kТ, (1.6)
а число дефектов по Шоттки
Nш=Ne-Uм/kT, (1.7)
где Uф, Uш - энергия образования дефектов по Френкелю и Шоттки; А- число одинаковых междоузлий, приходящихся на один атом решётки.
В технически чистых металлах точечные дефекты повышают электросопротивление, а на механические свойства почти не влияют. Лишь при больших концентрациях дефектов, например в облученных металлах, понижается пластичность материала и заметно изменяются другие свойства. В ионных и ковалентных кристаллах вакансии и другие точечные дефекты электрически активны и могут быть как донорами, так и акцепторами. Это создаёт в кристаллах преобладание определённого типа проводимости.
Линейные дефекты в кристаллах характерезуются тем, что их поперечные размеры не превышают несколько межатомных расстояний, а длина может достигать размера кристалла. К ним относятся дислокации - это линии, вдоль и вблизи которых нарушено правильное чередование атомных плоскостей кристалла. Основными видами дислокацийй являются краевые и винтовые (рис. 1. 12).
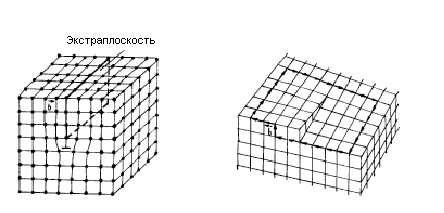
а) б)
Рис. 1.12. Схема краевой (а) и винтовой (б) дислокаций
Краевая дислокация образуется, когда какая-либо кристаллографическая плоскость обрывается внутри кристалла. Край этой "лишней" плоскости (экстраплоскости) и образует краевую дислокацию (рис. 1.12, a). Это место называется также ядром дислокации и обозначается значком ^.
Винтовая дислокация возникает вследствие сдвига одной части кристалла относительно другой (рис. 1.12, б).
Вокруг дислокаций на протяжении нескольких межатомных расстояний возникают искажения решётки. Мерой искажения служит так называемый вектор Бюргерса. Он получается, если провести замкнутый контур (контур Бюргерса) от узла к узлу в идеальном кристалле, а затем этот же путь повторить в реальном кристалле, заключив дислокацию внутрь контура. В реальном кристалле контур окажется незамкнутым на величину b (рис. 1.12, a), которая называется вектором Бюргерса. Для краевой дислокации вектор Бюргерса равен межатомному расстоянию и перпендикулярен линии дислокации, а для винтовой - параллелен ей (рис. 1.12, б).
Дислокации создают в кристалле вокруг себя поля упругих напряжений. Упругая энергия, обусловленная полем напряжений дислокаций, пропорциональна b2.
Важной характеристикой дислокационной структуры является плотность дислокаций r, под которой понимают суммарную длину дислокаций ∑ℓ∙1, см, приходящую на единицу объёма V кристалла, см3. Размерность плотности дислокаций r=∑ℓ /V, см-2(см/см3). Обычно в литых металлических поликристаллах плотность дислокаций составляет 106 - 108 см-2. При холодном пластическом деформировании r возрастает до 1011 - 1012 см-2. В полупроводниковых монокристаллах, выращенных в обычных условиях, r колеблется в педелах 102 - 105 см-2. При использовании специальных методов выращивания получают практически бездислокационные кристаллы кремния, германия и некоторых соединений АIII ВV.
Дислокации возникают в кристаллах в процессе его роста из расплава или раствора, при перекристаллизации в твёрдом состоянии, а также под воздействием механических усилий при пластической деформации.
В металлах дислокации облегчают пластическое деформирование и существенно влияют на механические свойства.
В полупроводниковых кристаллах дислокации влияют на электрические и оптические свойства, снижают электрическое сопротивление, уменьшают время жизни носителей тока. Значение дислокаций особенно возрастает в микроэлектронике, где применяются тонкие плёнки. В этом случае дислокации играют роль тонких проводящих каналов, вдоль которых легко перемещаются примесные атомы.
1.4. Жидкие кристаллы
Жидкие кристаллы - органические вещества с анизотропными молекулами, имеющими одно- или двухмерный дальний порядок в их расположении. Благодаря упорядочению молекул они занимают промежуточное положение между кристаллами и обычными жидкостями с беспорядочным расположением молекул. Определяющую роль в образовании жидкокристаллического состояния играет преимущественная Ван-дер-Ваальсовая связь между молекулами. Поэтому оптические и электрические свойства жидких кристаллов в сильной степени зависят от напряжённости электрического поля, температуры, давления. В жидкокристаллическом состоянии они могут существовать лишь в определённом интервале температуры. Ниже этого интервала вещество находится в твёрдом кристаллическом состоянии, выше - переходит в изотропную жидкость.
По структуре жидкие кристаллы разделяют на три типа: 1 -нематические; 2 - смектические; 3 - холестерические (рис. 1.13).
В нематических жидких кристаллах (НЖК) молекулы выстроены в цепочки (рис. 1.13, a). Направление преимущественной ориентации молекул является оптической осью НЖК.
В жидких кристаллах второго типа (СЖК) молекулы распределены слоями с чётко определённым периодом. В каждом слое молекулы ориентированы параллельно (рис. 1.13, б). Смектические жидкие кристаллы более упорядочены, чем неатические, вследствие этого обладают большой вязкостью и поэтому не получили широкого применения в технике.
Холестерические жидкие кристаллы (ХЖК) являются разновидностью НЖК. В отличии от нематических кристаллов ХЖК образованы оптически активными молекулами, образующими параллельные слои, подобно кристаллам первого типа.
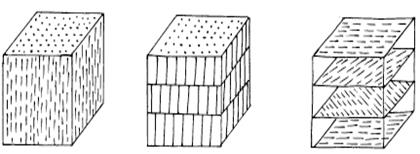
а) б) в)
Рис. 1.13. Типы структур жидких кристаллов: a - нематических; б -смектических; в – холестерических
Направление преимущественной ориентации молекул плавно меняется при переходе от слоя к слою, образуя винтовую ось симметрии, перпендикулярную плоскости слоя и направлению ориентации (рис. 1.13, в).
В настоящее время известно большое колличество органических соединений, способных образовывать жидкие кристаллы. НЖК представляют собой ароматические соединения, содержащие бензольные кольца с заместителями в параположении. Наиболее применяемыми ХЖК являются различные производные холестерина.
Ориентационный порядок в расположении молекул в ЖК создаёт анизотропию удельного электрического сопротивления, диэлектрической проницаемости, показателя преломления света, вязкости и других свойств.
Жидкие кристаллы, являющиеся органическими диэлектриками, обладают удельным объёмным электрическим сопротивлением, измеренным перпендикулярно молекулярным цепям, порядка 106 - 1010 Ом∙м, а вдоль молекулярных цепей значительно ниже.
Диэлектрическая анизотропия количественно определяется соотношением:
 =
= 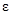 II-
II- 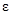 ^ (1.8)
^ (1.8)
где 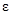 ^ и
^ и 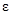 II – относительная диэлектрическая проницаемость соответственно поперёк и вдоль преимущественной ориентации молекул.
II – относительная диэлектрическая проницаемость соответственно поперёк и вдоль преимущественной ориентации молекул.
Значение и знак определяются поляризуемостью молекул, направлением собственного дипольного момента и величиной ∆ε; она может иметь как положительное, так и отрицательное значение.
Оптическая анизотропия определяется как разность оптических показателей преломления световой волны вдоль преимущественного направления молекул nII и перпендикулярно n^
∆n =nII -n^. (1.9)
Величина 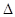 n всегда положительна и составляет 0.1...0.3.
n всегда положительна и составляет 0.1...0.3.
Сочетание в жидких кристаллах анизотропных свойств и низкой вязкости приводит к некоторым электрооптическим эффектам, которые применяются в качестве индикаторов в устройствах отображения информации. Такие устройства имеют малую потребляемую мощность, до 10 - 8 Вт/м2, низковольтный режим работы, 2...50 В, совместимость с интегральными схемами и возможность изготовления традиционными методами микроэлектроники.
Отдельные типы ЖК обычно не используются из-за узкого температурного интервала жидкокристаллического состояния. С целью расширения температурных границ существования мезофазы используются смеси из однотипных жидких кристаллов. Для получения цветных изображений в ЖК добавляют красители. Молекулы жидкого кристалла размещаются перпендикулярно электродам ячейки индикатора и увлекают за собой молекулы красителя. В таком положении окраска не видна. При подаче электрического напряжения молекулы красителя, увлекаемые молекулами ЖК, поворачиваются и окрашивают изображение в определённый цвет.
1.5. Структура полимеров, стекол и керамик
Полимерами называют вещества, молекулы которых построены из большого числа многократно повторяющихся структурных единиц-звеньев, связанными между собой химическими связями. Каждое звено представляет собой изменённую молекулу исходного низкомолекулярного вещества-мономера. При получении полимеров мономеры обьединяются друг с другом и образуют длинные линейные молекулы или макромолекулы, в которых атомы соединены ковалентными связями. Типичным примером служит полиэтилен (рис. 1.14).
Элементарным звеном является мономер СН2-СН2 (этилен). В макромолекуле [-СН2-СН2-]n (рис. 1.14) число n показывает количество мономеров, входящих в макромолекулу, и называется степенью полимеризации; она колеблется от единиц и десятков до несколько тысяч. При n равной несколько единиц полимер предстапляет собой газ; при n – несколько десятков полимер имеет вид жидкости; при n больше сотни – вердое вещество. Для характеристики полимера вводят молекулярную массу М=n·М3, , где М3- молекулярная масса звена (мономера).
Полимеры с низкой степенью полимеризации (n несколько десятков) называют олигомерами, с высокой степенью полимеризации - высокополимерами. Олигомеры при добавлениии или удалении одного или нескольких составных звеньев могут изменять комплекс свойств.
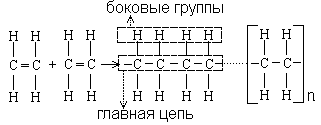
Рис. 1.14. Схема строения линейной макромолекулы
Полимеры, макромолекулы которых содержат несколько типов элементарных звеньев, называются сополимерами.
В зависимости от характера связи между макромолекулами полимеры подразделяются на линейные и пространственные, или сшитые.
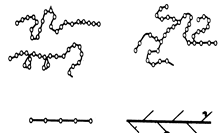
В линейных полимерах между макромолекулами действуют относительно слабые силы Ван-дер-Ваальса. По форме они представляют собой длинные зигзагообразные или закрученные в спираль цепочки, что определяется величиной угла связи между атомами главной цепочки (рис. 1.15, a)).
Линейные молекулы имеют главные цепи и боковые группы (рис. 1.14). У большинства полимеров главные цепи состоят преимущественно из атомов углерода, у кремнийорганических полимеров они образованы чередующимися атомами кремния и кислорода или атомами кремния. Боковые группы могут состоять из атомов (Н, F, Cl),или группы атомов (радикалов) - гидроксильные (ОН), метильные (СН3), этильные (С2Н5), фенильные (С6Н5), аминные (NH2), нитрильные (CN), карбоксильные (HCO2) и другие. Изменение вида боковых групп в линейных полимерах приводит к изменению природы и свойств полимера в целом. При наличии боковых групп нескольких видов они могут располагаться вдоль главной цепи молекулы как неупорядоченно, так и в определённом порядке. Полимеры с неупорядоченным чередованием групп называют нерегулярными, а с упорядоченным - регулярными.
a) б) в)
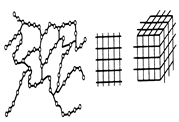
Рис. 1.15. Формы макромолекул полимеров: а - линейная; б - разветвлённая; в - пространственная
Линейные полимеры могут быть неполярными и полярными. Молекула полиэтилена неполярна - её результирующий электрический момент равен нулю. При замещении Н другими атомами или группами атомов полимер может оказаться как неполярным, так и полярным. Неполярная молекула получается при замещении Н неполярными группами - СН3, C2H5, C6H5. Если же заместитель является полярным (OH, COOH, NH2, CN и другие), то молекула полимера становится полярной. Полярными являются так же связи C-F, C-Cl. Но если полярные группы или связи располагаются в молекуле симметрично, то они компенсируют друг друга и тогда молекулярная цепь оказывается неполярной (например, политетрофторэтилен, имеющий структуру [-CF2-CF2-]n).
Общая структура линейных полимеров складывается из структуры молекул и надмолекулярной структуры, то есть взаимной укладки линейных молекул в полимерном веществе. Надмолекулярная структура появляется под влиянием сил притяжения между молекулами и теплового движения самих молекул. Наиболее характерной и важной формой теплового движения макромолекул являются повороты частей молекул по отношению друг к другу без нарушения (разрыва) связей между звеньями. Изменение формы макромолекулы за счёт поворотов отдельных её звеньев называют конформационным превращением. Для нерегулярных полимеров характерны пачечные структуры, когда на относительно больших участках главные цепи соседних молекул распологаются параллельно. У регулярных полимеров типичными надмолекулярными структурами являются кристаллы.
Наряду с линейыми полимерами существуют разветвлённые (рис. 1.15, б), в которых помимо главной цепи содержатся боковые цепи, длина и природа их может различаться. Разветвлённые макромолекулы являются промежуточной формой между линейными и пространственными полимерами.
Пространственные полимеры (рис. 1.15, в) имеют, кроме сил Ван-дер-Ваальса, ковалентные связи между молекулами, вследствии чего образуется пространственная сетчатая трёхмерная структура.
Поперечные связи между макромолекулами образуются в процессе образования полимера (полимеризации или поликонденсации) под действием химических веществ, вводимых в систему (вулканизация, отверждение), или ионизирующих излучений и других воздействий на заранее синтезированные линейные или разветвлённые полимеры, или олигомеры. Длина основной цепи и количество поперечных сшивок могут меняться в широких пределах, в соответствии с этим меняются и свойства образующегося полимера. Примерами сшитых полимеров могут служить отверждённые эпоксидные и фенолоформальдегидные смоламы, вулканизаторы каучука и другие. Для сшитых полимеров понятие "молекула" и молекулярная масса М утрачивает смысл.
Надмолекулярные структуры в пространственных полимерах зависят от плотности поперечных связей. При небольшой плотности поперечных связей образуются как пачечные структуры, так и кристаллы. При увеличении плотности их возможность образования надмолекулярных структур уменьшается.
Стекло представляет собой твёрдое аморфное вещество, образующееся при сплавлении оксидов и безоксидных соединений. Стеклообразующимися являются оксиды SiO2, B2O3, P2O5, GeO2 и некоторые безкислородные соединения селена, теллура, мышьяка и они определяют название стекла (например, силикатные стекла – оксид SiO2, боратные стекла – оксид – B2O3). Стеклообразующие оксиды создают обьемную сетку из однородных структурных элементов.
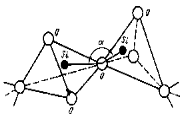
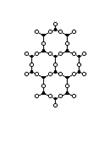
В кварцевом стекле, где стеклообразующим оксидом является SiO2,, структурными элементами являются тетраэдры SiO4,, которые соединяются своими вершинами (рис. 1.16,а). Углы между связями Si-O-Si в соседних тетраэдрах меняются в пределах 120 - 1800, благодаря чему создаётся неупорядоченное расположение тетраэдров SiO4 в структурной сетке стекла.
Кристаллический кварц состоит из таких же тетраэдров SiO4, что и кварцевое стекло. Но в кристаллическом кварце углы Si-O-Si имеют строго определённое значение, поэтому тетраэдры размещены упорядоченно и образуют кристаллическую решетку (рис. 1.16,б)).
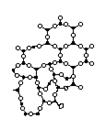
Аморфная структура кварцевого стекла (рис. 1.16, в) возникает при охлаждении расплавленной стеклянной массы, когда повышение её вязкости препятствует процессу кристаллизации.
Промышленные силикатные стёкла, кроме стеклообразователя SiO2, могут содержать алюминий, титан, щёлочно-земельные металлы, которые входят в структурную сетку стекла, и щелочные металлы: натрий, калий, размещающиеся в ячейках этой сетки. Усложнение химического состава стёкол приводит к изменению технологических, механических, электрических и оптических свойств.
 |  |  |
а) б) в)
Рис 1.16. Расположение тетраэдров SiO4 в стекле (а) и двухмерное схематическое изображение строения решётки кристаллического кварца (б) и кварцевого стекла (в)
Керамикой называют материалы, полученные при высокотемпературном спекании неорганических веществ, включая минералы и окислы. При нагреве исходные вещества взаимодействуют между собой, образуя кристаллическую структуру и аморфную фазу. Керамика представляет собой пористый материал, содержащий ковалентные или ионные кристаллы, сложные окислы, карбиды или твёрдые растворы на их основе. Аморфная фаза является стеклом, которое по химическому составу отличается от кристаллов. Керамический материал может содержать одну или несколько кристаллических фаз, отдельные виды керамики совсем не имеют стекла в своей структуре. Как правило, керамика имеет поликристаллическую структуру с прослойкой стеклофазы и с беспорядочным расположением зёрен. Поэтому она обладает изотропностью свойств по всему объёму. Механические и электрические свойства керамики зависят от вида исходных веществ, химического состава кристаллов и стекла и соотношения кристаллической и аморфной фаз. На свойства керамики влияет так же количество пор, которые определяются технологией изготовления. Физико-механические свойства тем выше, чем мельче кристаллы и чем меньше пористость. Например, наибольшей прочностью обладает плотная алюмооксидная керамика на основе Al2O3 с размерами зёрен 1-5 мкм и почти не имеющая пор в структуре.
Вопросы для самоконтроля
1. Приведите характеристики всех видов химических связей.
2. Что значит кристаллическая структура и элементарная ячейка?
3. Как определяются индексы узлов, направлений и плоскостей кристаллических решеток?
4. Приведите характеристики основных видов дефектов реальных кристаллических структур и причины их образования.
5. Какие бывают фазы жидких кристаллов и приведите примеры их использования?
6. Что означает ²аморфная структура²? Опишите структурные особенности линейных и пространственных полимеров. Приведите примеры линейных и пространственных полимеров.
7. Какие полимерные материалы называют термопластичными и какие термореактивными?
8. На примере силикатных стекол опишите структуру кварцевого стекла. В чем различие в структурах кварцевого стекла и кристаллического кварца?
9. Опишите фазовый состав керамик.
 2015-05-26
2015-05-26 1865
1865







