По мнению А. П. Виноградова химический состав организма определяется составом окружающей среды. Биосфера содержит 100 млрд тонн живого вещества. Около 50% массы земной коры приходится на кислород, более 25% на кремний. Восемнадцать элементов (О, Si, Al, Fe, Ca. Na, К, Mg, H, Ti, С, Р, N, S, Cl, F, Мn, Ва) составляют 99,8% массы земной коры. Живые организмы принимают активное участие в перераспределении химических элементов в земной коре. Минералы, природные химические вещества, образуются в биосфере в различных количествах, благодаря деятельности живых веществ. Изменения, происходящие в верхних слоях земной коры, влияют на химический состав живых организмов. В организме можно обнаружить почти все элементы, которые есть в земной коре и морской воде. Пути поступления элементов в организм разнообразны. Согласно биогеохимической теории Вернадского существует «биогенная миграция атомов» по цепочке воздух-> почва -> вода -> пища -> человек, в результате которой практически все элементы, окружающие человека во внешней среде, в большей или меньшей степени проникают внутрь организма. Элементы, жизненно необходимые организму, называют биогенными элементами.
Биогенные элементы, содержание которых превышает 0,01% от массы тела, относят к макроэлементам. К ним отнесены 12 элементов: органогены, составляющие 99,99% живого субстрата – это углерод, водород, кислород, азот, фосфор, кальций (С, Н, О, N, Р, Ca) и олигобиогенные элементы (элементы электролитного фона): К, Na, Mg, Fe, Сl, S, их cодержание колеблется от 0,1 до 1%.
Биогенные элементы, суммарное содержание которых составляет величину порядка 0,01%, относят к микроэлементам. Содержание каждого из них (10-3 – 10-5%). Большинство этих микроэлементов содержится в основном в тканях печени. Это депо микроэлементов. Некоторые микроэлементы проявляют сродство к определенным тканям (йод - к щитовидной железе, фтор - к эмали зубов, цинк - к поджелудочной железе, молибден - к почкам и т.д.).
Элементы, содержание которых меньше чем 10-5%, относят к ультрамикроэлементам. Данные о количестве и биологической роли многих элементов невыяснены до конца.
Некоторые из них постоянно содержатся в организме животных и человека: Ga, Ti, F, Al, As, Cr, Ni, Se, Ge, Sn и другие. Биологическая роль их мало выяснена. Их относят к условно биогенным элементам. Другие примесные элементы (Те, Sc, In, W, Re и другие) обнаружены в организме человека и животных, и данные об их количестве и биологической роли не выяснены. Примесные элементы также делят на аккумулирующиеся (Hg, Pb, Cd) и не аккумулирующиеся (Al, Ag, Go, Ti, F). Известны крылатые слова, сказанные в 40-х годах немецкими учеными Вальтером и Идой Ноддак: «В каждом булыжнике на мостовой присутствуют все элементы периодической системы». Если согласиться, что в каждом булыжнике содержатся все элементы, то тем более это должно быть справедливо для живого организма.
Все живые организмы имеют тесный контакт с окружающей средой. Жизнь требует постоянного обмена веществ в организме. Поступлению в организм химических элементов способствует питание и потребляемая вода. Организм состоит из воды на 60%, 34% приходится на органические вещества и 6% на неорганические. Основными компонентами органических веществ являются С, Н, О. В их состав входят также N, P, S. В составе неорганических веществ обязательно присутствуют 15 химических элемента (смотрите таблицу 10.1.). Например, если вес человека составляет 70 кг, то в нём содержится (в граммах): Са - 1700, К - 250, Na –70, Mg - 42, Fe - 5, Zn - 3. На долю металлов приходится 2,1 кг.
Таблица 10.1.
Суточное поступление химических элементов в организм человека
| Химический элемент | Суточное потребление, в мг | |
| Взрослые | Дети | |
| Калий | 2000-5500 | |
| Натрий | 1100-3300 | |
| Кальций | 800-1200 | |
| Магний | 300-400 | |
| Цинк | ||
| Железо | 10-15 | |
| Марганец | 2-5 | 1,3 |
| Медь | 1,5-3,0 | 1,0 |
| Титан | 0,85 | 0,06 |
| Молибден | 0,075-0,250 | - |
| Хром | 0,05-0,20 | 0,04 |
| Кобальт | Около 0,2 витамин B12 | 0,001 |
| Хлор | ||
| РО43- | 800-1200 | |
| SO42- | – | |
| Йод | 0,15 | 0,07 |
| Селен | 0,05-0, 07 | – |
| Фтор | 1,5-4,0 | 0, 6 |
Столько же химических элементов должно выводиться, поскольку их содержание в организме находится в относительном постоянстве.
При недостаточном поступлении элемента в организм наносится существенный ущерб росту и развитию организма. Это объясняется снижением активности ферментов, в состав которых входит элемент. При повышении дозы этого элемента ответная реакция организма возрастает, достигает нормы (биотическая концентрация элемента).
Дальнейшее увеличение дозы приводит к снижению функционирования вследствие токсического действия избытка элемента вплоть до летального исхода. Дефицит и избыток биогенного элемента наносит вред организму. Все живые организмы реагируют на недостаток и избыток или неблагоприятное соотношение элементов. Характерным признаком жизненной необходимости элемента является колоколообразный характер кривой, построенной в координатах: ответная реакция организма (R) - доза элемента (Д). Чем больше ширина плато, тем меньше токсичность элемента (рис. 10.1.).
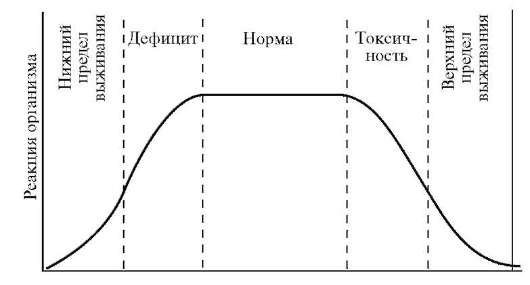
Рис.10.1. Признаком жизненной необходимости элемента, построенной в координатах: ответная реакция организма (R) - доза элемента (Д).
Биогенность 30 химических элементов установлена. Но часть химических элементов периодической системы Д.И. Менделеева для живх организмов проявляет токсические свойства. Токсичные элементы (тяжелые металлы) – это химические элементы, оказывающие отрицательное влияние на живые организмы, которое проявляется только при достижении некоторой концентрации, определяемой природой организма.
Многие тяжелые металлы проявляют высокую токсичность в следовых количествах и концентрируются в живых организмах. В отличие от органических загрязняющих веществ, подвергающихся в природной среде процессам разложения, металлы способны лишь перераспределяться между природными средами.
Поступление тяжелых металлов в окружающую среду имеет как естественное, так и техногенное происхождение. Техногенная доля меди и цинка в атмосфере составляет примерно 75%, кадмия и ртути – 50%, никеля – 30%, кобальта – 10%. Наиболее высокая эмиссия в атмосферу характерна для свинца. По различным оценкам она составляет от 50 до 80%. Главными антропогенными источниками поступления тяжелых металлов в объекты биосферы являются предприятия по добыче и производству цветных металлов и сплавов, нефтепереработка, автомобильный транспорт, химическая промышленность, сельское хозяйство и др.
В результате воздействия загрязненной окружающей среды, а также при нарушении технологической обработки или условий хранения в пищевых продуктах могут появиться токсичные химические элементы, которые чрезвычайно токсичны даже в микроскопических дозах. Поэтому важной задачей является постоянный контроль пищевого сырья и готовой продукции, для того, чтобы обеспечить выпуск безвредных для здоровья продуктов питания.
Дозы токсичных металлов обозначены в международных требованиях, предъявляемых к пищевым продуктам объединенной комиссией ФАО (Продовольственная организация ООН) и ВОЗ (Всемирная организация здравоохранения), в документе под названием «Кодекс алиментариус». В соответствии с этим документом наиболее важными в гигиеническом контроле пищевых продуктов являются восемь элементов – ртуть,свинец, кадмий, мышьяк, медь, цинк, олово и железо.
Накопление химических элементов во внутренних органах человека приводит к развитию различных заболеваний. Больше всего в организме человека накапливаются кадмий, хром – в почках; медь – в желудочно-кишечном тракте; ртуть – в центральной нервной системе; цинк – в желудке, двигательном аппарате; мышьяк – в почках, печени, легких, сердечно-сосудистой системе; селен – в кишечнике, печени, почках; бериллий – в органах кроветворения, нервной системе. Наибольшую опасность среди всех перечисленных элементов представляют ртуть, свинец и кадмий. И даже если тяжелые металлы не являются основной причиной каких-либо заболеваний, они, наряду с другими токсинами, могут быть сопутствующим фактором, вызывающим лавину эффектов, приводящих к расстройству иммунной системы индивида. Спровоцированная металлами иммунная недостаточность может просто давать возможность одному из вирусов остаться активным или неконтролируемым. Корь, вирусы-невидимки, герпес или другой вирус, так же как и дрожжи получают прочного союзника в лице тяжелых металлов. Более того, это может заставить иммунную систему направить свои усилия по ложному руслу. Отравленная токсинами ртути иммунная система может спровоцировать борьбу против ни в чем неповинных пыльцы, пыли или продуктов питания в форме сильной аллергии, игнорируя при этом болезнетворные организмы, с которыми ей следовало бы вести борьбу. Токсичные металлы могут также способствовать укреплению и стимулированию дрожжевых и бактериальных проблем. Некоторые люди попросту не могут справиться с брожением в организме, пока не очистятся от металлов. После этого дрожжи как будто исчезают. То же касается попыток избавиться от многих пищевых проблем.
Для большинства продуктов питания установлены ПДК токсичных элементов, к детским и диетическим продуктам предъявляются более жесткие требования. ПДК некоторых тяжелых металлов в продуктах питания приведены в таблице 10.2..
Тяжелые металлы в почвах находятся в зависимости от их физико-химических свойств в различных состояниях и в связи с этим ведут себя по-разному. Так, соединения кадмия до 70% связываются с почвенными химическими комплексами, доступными для усвоения растениями. Иначе ведут себя в почвах соединения никеля. Значительные их количества аккумулируются в илистых, богатых гумусом почвах. Свинец и его соединения активно поглощаются биомассой, а соединения ртути более подвижны в кислых почвах с невысоким содержанием гумуса.
Ртуть. Один из самых опасных и высокотоксичных элементов, обладающий способностью накапливаться в организме растений, животных и человека. В природе находится в трех состояниях: металлическая – Hg0, одновалентный ион, состоящий из двух ядер, соединенных ковалентной связью – (Hg-Hg)2+, двухвалентный ион – Hg2+. Благодаря таким своим физико-химическим свойствам, как растворимость и летучесть, ртуть и ее соединения широко распространены в природе. В земной коре содержание составляет 0,5 мг/кг, в морской воде – около 0,03 мкг/л, в организме взрослого человека – около 13 мг, однако необходимость ее для процессов жизнедеятельности не доказана.
Распределение и миграция ртути в окружающей среде осуществляются в виде круговорота двух типов:
– перенос паров ртути от наземных источников в мировой океан;
– циркуляция соединений ртути, образуемых в процессе жизнедеятельности бактерий.
Загрязнение пищевых продуктов ртутью может происходить в результате:
– естественного процесса испарения из земной коры в количестве 25–125 тыс. т ежегодно;
– использования ртути в народном хозяйстве (производство хлора и щелочей, амальгамная металлургия, электротехническая промыш ность, медицина и стоматология, сельское хозяйство). Например, использование каломели (хлориды ртути: Hg2Cl2 – каломель и HgCl2 – сулема; каломель применяетсяидля изготовления гальванических электродов, в медицине как противомикробное средство; сулема – сильный яд, хорошо растворима в воде; используется для протравливания семян, дезинфекции белья, одежды, как ктализатор ряда органических реакций) в качестве антисептика, раствора
сулемы для дезинфекции, ртутной серной мази – при кожных заболеваниях, фунгицидов, которые вносят в почву, а также протравливают ими семена, проводят опыливание и опрыскивание растений.
Второй тип круговорота, связанный с метилированием неорганической ртути, является наиболее опасным, поскольку приводит к образованию метилртути, диметилртути, других высокотоксичных соединений, поступающих в пищевые цепи. Метилирование ртути осуществляют аэробные и анаэробные микробы, а также микромицеты, обитающие в почве и в верхнем слое донных отложений водоемов. Предполагается, что метилирование ртути микроорганизмами может осуществляться при определенных условиях в кишечнике животных и человека.
Фоновое содержание ртути в съедобных частях сельскохозяйствен-ных растений составляет от 2 до 20 мкг/кг, редко – до 50–200 мкг/кг,
среднее содержание в овощах – 3–59, фруктах – 10–124, бобовых – 8–16,
зерновых – 10–103 мкг/кг. Наибольшая концентрация ртути обнаружена
в шляпочных грибах – 6–447 мкг/кг, в перезрелых – до 2000 мкг/кг. В
отличие от растений, в грибах может синтезироваться метилртуть.
Фоновое содержание в продуктах животноводства составляет, мкг/кг: мясо – 6–20, печень – 20–35, почки – 20–70, молоко – 2–12, коровье масло –2–5, яйца – 2–15. С увеличением количества ртути в корме и питьевой воде ее концентрация в органах и тканях существенно возрастает. Мясо рыбы отличается наибольшей концентрацией ртути и ее соединений, поскольку активно кумулирует их из воды и корма, в который входят другие гидробионты, богатые ртутью. В мясе хищных пресноводных рыб уровень ртути составляет 107– 509 мкг/кг, нехищных – 79–200 мкг/кг, океанических – 300–600 мкг/кг.
Организм рыб способен синтезировать метилртуть, которая накаплива-ется в печени при достаточном содержании в корме цианокобаламина (витамина В12). При загрязнении рек, морей и океанов ртутью ее уровень в гидробионтах намного увеличивается и становится опасным для здоровья человека.
При варке рыбы и мяса концентрация ртути в них снижается, при аналогичной обработке грибов – остается без изменений. Такое принципиальное различие связано с тем, что в грибах ртуть связана с аминогруппами азотсодержащих соединений, а в рыбе и мясе – с серосодержащим аминокислотами.
Токсичность ртути зависит от вида соединений, которые по-разномуивсасываются, метаболизируются и выводятся из организма. Наиболее токсичны алкилртутные соединения с короткой цепью – метилртуть (CH3Hg) и этилртуть (C2H3Hg).
Механизм токсического действия ртути связывают с ее взаимодействием с SH-группамп белков. Блокируя их, ртуть изменяет свойства или инактивирует ряд жизненно важных ферментов.
Неорганические соединения ртути нарушают обмен аскорбиновой кислоты, пиридоксина, кальция, меди, цинка, селена, органические – обмен белков, цистеина, аскорбиновой кислоты, токоферолов, железа, меди, марганца, селена.
Клиническая картина хронического отравления организма небольшими
дозами ртути получила название микромеркуриализма (от ср.-век. лат. mercurius – название ртути у алхимиков).
Защитным эффектом при воздействии ртути на организм человека обладает цинк и, особенно, селен. Предполагается, что защитное действие селена обусловлено образованием нетоксичного селенортутного комплекса за счет деметилирования ртути. Токсичность неорганических соединений ртути снижают аскорбиновая кислота и медь при их повышенном поступлении в организм, органических – протеины, цистин, токоферолы.
Безопасным уровнем содержания ртути в крови считается 50–100
мкг/л, волосах – 30–40 мкг/г, моче – 5–10 мкг/сутки. С суточным рационом человек получает 0,045–0,060 мг ртути, что приблизительно соответствует рекомендуемой ФАО/ВОЗ по ДСП – 0,05 мг. ПДК ртути в водо проводной воде составляет 0,005 мг/л, стандарт ВОЗ – 0,01 мг/л.
Кадмий, В природе в чистом виде не встречается, образуется как со-путствующий продукт при рафинировании цинка и меди. Земная кора содержит около 0,05 мг/кг кадмия, морская вода – 0,3 мкг/кг. Кадмий широко применяется в различных отраслях промышленности – при производстве защитных гальванических покрытий, пластмасс, полупроводников. В ряде стран соли кадмия используются в ветеринарии как антигельминтные и антисептические препараты. Фосфатные удобрения и навоз также содержат кадмий в виде соединений.
В геохимических регионах с относительно благополучной экологи-ческой обстановкой содержание кадмия в растительных продуктах как правило составляет, мкг/кг: зерновые – 28–95; горох – 15–19; фасоль – 5–12; картофель – 12–50; капуста – 2–26; помидоры – 10–30; салат – 17– 23; фрукты – 9–42; растительное масло – 10–50; сахар – 5–31; грибы – 100–500; в продуктах животного происхождения, в среднем, мкг/кг: молоко – 2,4; творог– 6; яйца – 23–250.
Установлено, что приблизительно 80% кадмия поступает в организм человека с пищей, 20% – через легкие из атмосферы и при курении. С рационом взрослый человек получает в сутки до 150 и более мкг кадмия на 1 кг массы тела. В одной сигарете содержится 1,5–2,0 мкг кадмия, поэтому его уровень в крови и почках у курящих в 1,5–2,0 раза выше по сравнению с некурящими. От 92 до 94% кадмия, попавшего в организм с пищей, выводится. Остальная часть находится в органах и тканях в ионной форме или в комплексе с низкомолекулярным белком – металлотионеином. В виде этого соединения кадмий не токсичен, поэтому синтез металлотионеина является защитной реакцией организма при поступлении относительно небольших количеств кадмия. Здоровый организм человека содержит около 50 мг кадмия. Интересно отметить, что в организме новорожденных он отсутствует и появляется лишь к десятому месяцу жизни. Считается, что кадмий, как и ртуть, не является необходимым элементом для организма млекопитающих.
Попадая в организм в больших дозах, проявляет сильные токсические свойства. Главной мишенью биологического действия кадмия являются почки. Механизм токсического действия кадмия связан с блокадой сульфгидрильных групп белков. Кроме этого, он является антагонистом цинка, кобальта, селена из-за ингибирования активности ферментов, содержащих указанные металлы. Известна способность кадмия в больших дозах нарушать обмен железа и кальция, что приводит к возникновению широкого спектра заболеваний: гипертоническая болезнь, анемия, снижение иммунитета и др.
Отмечены тератогенный («в утробе», от лат «uterus» — матка, возникновение пороков развития и уродств), мутагенный и канцерогенный эффекты кадмия. Допустимое суточное потребление (ДСП) кадмия составляет 70 мкг/сутки, ДСД – 1 мкг/кг массы тела.
ПДК кадмия в питьевой воде – 0,01 мг/л, концентрация в сточных водах, попадающих в водоемы, не должна превышать 0,1 мг/л. С учетом величины ДСП кадмия, его содержание в 1 кг суточного набора продуктов не
должно превышать 30–35 мкг.
Важное значение в профилактике интоксикации кадмием имеет пра-вильное питание: преобладание в рационе растительных белков, богатое содержание серосодержащих аминокислот, аскорбиновой кислоты, железа, цинка, меди, селена, кальция. Белки молока способствуют накоплению кадмия в организме и проявлению его токсических свойств.
При определении кадмия в пищевых продуктах необходимо учитывать его способность испаряться при температуре 500ºС в условиях озоления. В связи с этим минерализацию проводят в серной кислоте с добавлением перекиси водорода. В качестве основного метода используют атомно-адсорбционную спектрофотомерию, а также полярографию.
Свинец. Один из самых распространенных и опасных ксенобиотиков.
В земной коре содержится в незначительных количествах. Вместе с тем мировое производство свинца составляет более 3,5-106 т в год, и огромное его количество, преимущественно, в виде различных высокотоксичных химических соединений загрязняет атмосферу, гидросферу, литосферу.
Содержание свинца в продуктах питания, в среднем, составляет 0,2 мг/кг, по отдельным группам продуктов, мг/кг: фрукты – 0,01–0,6, овощи 0,02–1,6, крупы – 0,03–3,хлебобулочные изделия – 0,03–0,82, мясо и рыба – 0,01– 0,78, молоко – 0,01–0,1.
Следует отметить активное накопление свинца в растениях и мясе сельскохозяйственных животных вблизи промышленных центров, а также крупных автомагистралей, где в автомобилях используется этилированный бензин. Взрослый человек получает ежедневно с пищей 0,1– 0,5 мг свинца, с водой – до 0,02 мг, общее его содержание составляе около 120 мг.
В организме взрослого человека усваивается в среднем 10% поступившего свинца, у детей – от 30 до 40 %. Из крови свинец поступает в мягкие ткани и кости, где депонируется (от лат. depono – кладу) в виде трифосфата. Биологический период выведения свинца составляет из мягких тканей и органов – около 20 суток, из костей – до 20 лет.
Механизм токсического действия свинца реализуется по двум основ-ным направлениям:
– блокада функциональных SH-групп белков, что приводит к ингибированию многих жизненно важных ферментов;
– проникновение свинца в нервные и мышечные клетки, образование лактата свинца путем взаимодействия с молочной кислотой, затем фосфатов свинца, которые создают клеточный барьер для проникновения в нервные и мышечные клетки ионов кальция.
Основными мишенями при воздействии свинца являются кроветворная, нервная, пищеварительная системы и почки. Отмечено также отрицательное влияние на половую функцию организма – угнетение активности стероидных гормонов.
Дефицит в рационе кальция, железа, пектинов, белков или повышенное поступление кальциферола (кальциферолы – жирорастворимые витамины, регулируют обмен кальция и фосфора в организме, необходимы для роста костей) способствуют усвоению свинца, а, следовательно, проявлению его токсичности.
По данным ФАО ООН, допустимая суточная доза свинца составляет около 0,007 мг/кг массы тела, ПДК в питьевой воде – 0,05 мг/л.
Мероприятия по профилактике загрязнения свинцом пищевых про-дуктов должны включать государственный и ведомственный контроль за промышленными выбросами свинца в атмосферу, сбросы в водоемы, попаданием в почву.
Необходимо резко ограничить применение тетраэтилсвинца в свинцовых стабилизаторах, изделиях из поливинилхлори-да, красителях, упаковочных материалах.
Важное значение имеет гигиенический контроль паяной и луженой металлической тары, а также глазурованной керамической посуды, некачественное изготовление которых ведет к загрязнению продуктов питания свинцом.
Мышьяк. Природный мышьяк находится в элементном состоянии, в виде арсенидов и арсеносульфидов тяжелых металлов. Содержится во всех объектах биосферы: морской воде – около 5 мкг/кг, земной коре – 2 мг/кг, в наибольших количествах – в рыбах и ракообразных.
Фоновый уровень мышьяка в продуктах питания из обычных геохимических регионов составляет, в среднем 0,5–1,0, мг/кг: в овощах и фруктах – 0,01– 0,2, зерновых – 0,006–1,2, говядине и свинине – 0,005–0,05, яйцах – 0,003–0,03, коровьем молоке и кисломолочных продуктах – 0,005-0,01, твороге – 0,003–0,03.
Высокая концентрация мышьяка, как и других химических элементов, отмечается в пищевых гидробионтах (от греч. hydor – вода, от греч. bios – жизнь), в частности морских. В организме человека обнаруживается около 1,8 мг мышьяка.
По данным экспертов ФАО/ВОЗ ООН суточное поступление мышьяка в организм взрослого человека составляет в среднем 0,05–0,42 мг, т.е. около 0,007 мг/кг массы тела и может достигать 1 мг в зависимости от его содержания в потребляемых продуктах питания и проникновения из других объектов окружающей среды. ФАО/ВОЗ установила ДСД мышьяка в количестве 0,05 мг/кг массы тела, что составляет для взрослого человека около 3 мг/сутки.
Мышьяк, в зависимости от дозы, может вызывать острое и хроническое отравление. Хроническая интоксикация возникает при длительном употреблении питьевой воды с 0,3–2,2 мг/л мышьяка, разовая доза мышьяка в 30 мг смертельна для человека.
Механизм токсического действия мышьяка связан с блокированием тиоловых групп – SH, связаных с углеводородным радикалом (R=CH3, C2H5 и др.) групп ферментов, контролирующих тканевое дыхание, деление клеток, другие жизненно важные функции. Специфическими симптомами интоксикации считается утолщение рогового слоя кожи ладоней и подошв.
Неорганические соединения мышьяка более токсичны, чем органические. После ртути, мышьяк является вторым по токсичности контаминантом пищевых продуктов, соединения мышьяка хорошо всасываются в пищевом тракте, около 90% поступившего в организм мышьяка выделяется с мочой.
Биологическая ПДК мышьяка в моче равна 1 мг/л, а его концентрация 2–4 мг/л свидетельствует об интоксикации. В организме мышьяк накапливается в эктодермальных (от греч. ektos – вне, снаружи) тканях волосах, ногтях, коже. Биологический период мышьяка в организме составляет 30–60 часов. За исключением стимулирующего действия мышьяка на процесс кроветворения (терапевтические свойства мышьяка известные уже более 2000 лет), его необходимость для жизнедеятельности организма человека до настоящего времени не доказана.
Загрязнение продуктов питания мышьяком обусловлено его использованием в сельском хозяйстве в качестве родентицидов, инсектицидов, фунгицидов, древесных консервантов, стерилизатора почвы.
Мышьяк находит широкое применение в производстве полупроводников, стекла, красителей. Недостаточно эффективный контроль за использованием мышьяка и его соединений в промышленном и сельскохозяйственном производстве может приводить к накоплению мышьяка в продовольственном сырье и продуктах питания, что обуславливает возможность сильных интоксикаций организма человека. Медь. Содержание в земной коре составляет 4,5 мг/кг, в морской воде – от 1– до 25 мкг/л, в организме взрослого человека – около 100 мг. В отличие от ртути и мышьяка, медь принимает активное участие в процессах жизнедеятельности, входя в состав ряда ферментных систем. Суточная потребность для человека составляет 4–5 мг, дефицит меди приводит к анемии, недостаточности роста, ряду других заболеваний, в отдельных случаях – к летальному исходу.
Однако при длительном воздействии высоких доз меди наступает «поломка» механизмов адаптации, переходящая в интоксикацию и специфическое заболевание. В связи с этим защита окружающей природнойсреды и пищевой продукции от чрезмерного загрязнения медью и ее соединениями также является актуальной задачей. Основные источники загрязнения медью – выбросы и сбросы промышленных предприятий ватмосферу и в водоемы, передозировка инсектицидов, потребление напитков и других пищевых продуктов, соприкасающихся в процессе их производства с медными деталями оборудования или медной тарой.
Цинк. Содержится в земной коре в количестве 65 мг/кг, в морской воде – 9 –21 мкг/кг, в организме взрослого человека – 1,4–2,3 г/кг. Цинк входит в состав около 80 ферментов, участвуя тем самым во многих реакциях обмена веществ.
Типичными симптомами недостаточности цинка является замедление роста у детей, половой инфантилизм (от лат. infantilis – детский; сохранение у взрослых особей физических и психических черт, свойственных детскому возрасту), нарушение вкуса (гипогезия) и обоняния (гипосмия) и др.
Суточная потребность в цинке взрослого человека составляет 15 мг, при беременности и лактации – 20–25 мг. Цинк, содержащийся в растительных продуктах, менее доступен для организма – усвояемость 10%, поскольку фитин растений и овощей связывает цинк, в то же время из продуктов животного происхождения цинк усваивается на 40%. Содержание цинка в пищевых продуктах, как правило, составляет, мг/кг: мясо – 20–40, рыбопродукты – 15–30, устрицы – 60–1000, яйца – 15–20, фрукты и овощи – 5, картофель, морковь – около 10, орехи, зерновые – 25–30, мука высшего сорта – 5–8, молоко – 2–6 мг/л. В суточном рационе взрослого человека содержание цинка составляет 13–25 мг. Цинк и его соединения малотоксичны, содержание цинка в воде в концентрации до 40 мг/л практически безвредно для человека.
Вместе с тем возможны случаи интоксикации цинком, например, при нарушении гигиенических нормативов по использованию цинксодержащих пестицидов, неправильном терапевтическом применении препаратов цинка, в присутствии сопутствующих мышьяка, кадмия, марганца и свинца в атмосфере и т.п. Известны случаи отравления пищей и напитками, хранившимися в оцинкованной металлической посуде при со держании 200–600 мг/кг и более цинка, поэтому приготовление и хранение пищевых продуктов и воды в оцинкованной посуде гигиеническими нормативами запрещено. ПДК цинка в питьевой воде составляет 5 мг/л, для водоемов рыбохозяйственного назначения – 0,01 мг/л.
Железо. Занимает четвертое место среди наиболее распространенных в земной коре элементов (5% земной коры, по массе). Оно необходимо для жизнедеятельности как растительных, так и животных организмов. У растений дефицит железа проявляется в желтизне листьев и называется хлорозом, у человека вызывает железодефицитную анемию, поскольку двухвалентное железо – кофактор в гемосодержащих ферментах, участвует в образовании гемоглобина. Железо выполняет также целый ряд других жизненно важных функций, таких, например, как перенос кислорода, образование эритроцитов, обеспечение активности негемовых ферментов и др.
В организме взрослого человека содержится около 4,5 г железа. Содержание железа в пищевых продуктах колеблется в пределах 0,07–4,0 мг/100 г. Основными источниками железа в продуктах питании являются печень, почки, бобовые культуры (6–20 мг/100 г). Потребность взрослого человека в железе составляет около 14 мг/сутки, у женщин в период беременности и лактации она заметно возрастает. При этом из мясных продуктов железо усваивается организмом на 30%, из растений – на 10%. Последнее обстоятельство связано с тем, что растительные продукты содержат фосфаты и фитин, которые образуют с железом трудно растворимые соли и препятствуют его усвояемости. Чай также снижает усвояемость железа в результате связывания его дубильными веществами в труднорастворимый комплекс.
Несмотря на важнейшую положительную роль железа в обмене веществ, оно может оказывать сильное токсическое действие при поступлении в организм в повышенных количествах, существенно повышая вероятность интоксикации организма человека.
Загрязнение продуктов питания железом может происходить как через продовольственное сырье, так и при контакте с поверхностями металлического оборудования и металлической тарой.
Олово. Количество олова в земной коре относительно невелико, необходимость олова для организма человека не доказана. Вместе с тем пищевые продукты содержат этот элемент до 1–2 мг/кг, организм взрослого человека – около 17 мг, что указывает на возможность участия олова в обменных процессах.При поступлении олова с пищей всасывается около 1%, выводится олово с мочой и желчью.
Неорганические соединения олова малотоксичны, органические более токсичные, находят применение в сельском хозяйстве в качестве фунгицидов, в химической промышленности – как стабилизаторы поли-винилхлоридных полимеров.
Основным источником загрязнения пищевых продуктов оловом являются консервные банки, фляги, другая тара и оборудование, в процессе производства которых применяется лужение и гальванизация.
Активность перехода олова в пищевые продукты возрастает при температуре хранения выше 20°С, а также при высоком содержании в продукте органических кислот, нитратов и окислителей, которые повышают растворимость олова. Повышенная концентрация олова в продуктах питания придает им неприятный металлический привкус, изменяет цвет.
Установлено, что опасность отравления оловом увеличивается в при-сутствии свинца. Не исключено взаимодействие олова с отдельными ин-гредиентами пищи с образованием токсичных органических соединений. Имеются данные, что токсичная доза олова, при его однократном поступлении составляет 5–7 мг/кг массы тела, т. е. 300–500 мг.
Отравление оловом может вызвать признаки острого гастрита, отрицательно повлиять на активность пищеварительных ферментов.Действенной мерой предупреждения загрязнения продуктов питания оловом является покрытие внутренней поверхности тары и оборудования гигиенически безопасным полимерным материалом, соблюдение сроков хранения баночных консервов, особенно продуктов детского питания, использование для некоторых видов консервов стеклянной тары.
Стронций: Это довольно распространенный в литосфере металл, химически очень активен, поэтому сам металл применяют мало: при выплавке меди и бронз для их очистки, в электровакуумной технике как геттер – вещество, поглощающее газы (кроме инертных), его соли – в производстве красок, светящихся составов, глазурей и эмалей.
Концентрация в плодах, растущих на нормальной почве, колеблется от 1 до 169 мг/кг, в животных тканях – от 0,06 до 0,50 мг/кг. Взрослый человек поглощает с пищей обычно от 0,4–2,0 мг стронция в день.
Стронций плохо абсорбируется в кишечном тракте, поэтому основная часть металла, попавшего в организм, выделяется, а оставшийся в организме стронций замещает кальций и накапливается в костях. При значительном количестве накопленного стронция возникает вероятность подавления процесса кальцинирования растущих костей и остановки роста. По этой причине стабильный стронций в определенной степени опасен для здоровья человека, поэтому, согласно требованиям ФАО/ВОЗ ООН, его количественное содержание в продовольственном сырье и продуктах питания подлежит обязательному контролю.
Сурьма. В природе сурьма обычно встречается в виде сульфида:сурьмяного блеска (антимонита). Ежегодно производится около 70 тыс.тонн сурьмы, основные страны-производители – ЮАР, Боливия и Китай. Она используется при получении свинцовых, медных и других сплавов, которые применяются для изготовления подшипников, аккумуляторов, печатных шрифтов, вводится в свинцово-оловянистые припои.
По механизму токсического действия и клинической картине отравления сурьма аналогична мышьяку. Токсической дозой для взрослого человека является 100 мг/сутки, летальной – 500–1000 мг/сутки.
Профилактические мероприятия состоят в строгой регламентами со-держания и характера соединений сурьмы в эмали, полуде, а также в свинцово-оловянистых припоях.
Никель. В природе никель присутствует обычно совместно с мышьяком, сурьмой и серой. Среди наиболее важных с промышленной точки зрения руд является гарниерит – магний-никелиевый силикат. Никель используется при производстве сплавов с железом, медью, алюминием, хромом, цинком и молибденом для получения огнеупорных и коррозионно-стойких сталей, а также чугуна. Никелированные стали применяются при производстве некоторых видов пищевого оборудования.
Поскольку никель присутствует в небольших количествах практически во всех почвах, растения могут содержать его от 0,5 до 3,5 мг/кг. В довольно значительных количествах никель содержится в большинстве тканей животных.
Суточная норма поступления никеля в организм человека с пищей составляет 0,3–0,6 мг. Источниками загрязнения никелем пищевых продуктов могут являться почва и применяемое в пищевой промышленности никельсодержащее металлическое оборудование.
Никель относительно плохо абсорбируется из пищевых продуктов и напитков: в тканях организма остается лишь около 3–6% ежедневно поглощаемого металла. Распределяется никель в организме почти однородно, без преимущественного накопления в каких-либо органах. Предположительно никель необходим человеку, однако, до настоящего времени это научно не доказано. Он активирует некоторые ферменты, хотя и не является их единственным активатором. К таким ферментам относятся карбоксилаза, трипсин и ацетил-кофермент-А-синтетаза. Некоторое количество никеля в организме человека находится в специфическом никельсодержащем белке – никелоплазмине.
В случае избыточного поступления никеля в организм человека, например, у рабочих предприятий, занятых его очисткой, отмечены случаи онкологии органов дыхания и дерматиты. Принимая во внимание возможность негативного воздействия никеля на организм и здоровье человека, токсикологи достаточно жестко регламентируют его содержание в продуктах питания человека.
Хром. Широко распространен в земной коре и составляет 0,04% твердой породы. В основном он применяется в металлургической промышленности и машиностроении для получения нержавеющих сталей и покрытий на металлических изделиях, преимущественно гальванических, с целью противокоррозионной защиты и улучшения декоративных свойств. Феррохром и хром используются в металлургии в качестве легирующих добавок, а также для получения красок в полиграфической промышленности. Неорганические и органические соединения хрома добавляют в качестве эффективных универсальных противокоррозионных агентов (ингибиторов) в различные среды, преимущественно в воду.
Все это может приводить к существенному загрязнению окружающей природной среды и продуктов питания высокотоксичными хроматами.В незначительных количествах хром находится в большинстве пищевых продуктов и напитков.
Среднее суточное потребление хрома с пищей составляет приблизительно 50–80 мкг. Наибольшую потенциальную опасность в качестве источника повышенной концентрации хрома в пищевых продуктах представляют загрязненные им сточные воды. В то же время, по биологическому действию на организм хром является необходимым элементом. Основная его роль заключается в поддержании нормального уровня глюкозы в организме.
Недостаток этого элемента в организме вызывает нарушение глюкозного и липидного обмена и может привести к диабету и атеросклерозу. Известны также острые и хронические заболевания, вызванные воздействием на организм избыточного содержания хрома и его соединений. Так, рабочие кожевенных заводов страдают хронической язвой, возникающей под действием соединений шестивалентного хрома, у работающих с хромом и его соединениями людей, встречается аллергическая экзема и другие формы дерматита, а также онкологические заболевания верхних дыхательных путей и легких.
Летальной для человека является концентрация 3–8 г/сутки, токсичной – 200 мг/сутки, несколько меньшие количества вызывают повреждения почек и печени. Эксперты ФАО/ВОЗ ООН регламентируют содержание хрома в пищевых продуктах до значения ПДК, равная 0,5мг/кг продукции.
Алюминий. Самый распространенный металл в литосфере, он составляет 8% земной коры, в природе встречается в виде силикатов. Несмотря на богатые залежи, алюминий впервые был выделен только в 1825 г. В промышленности алюминий получают из бокситных руд и минерала криолита, основные месторождения которых находятся в Карибском бассейне, Бразилии и ЮАР.
В пищевой промышленности широко применяют бентонит– коллоидные глины, или природный гидратированный алюмосиликат, для осветления жидких сред – соков, пива, вина, напитков, сиропов и т.д.
Алюминий используется значительно чаще, чем другие технологические металлы – в электротехнической, автомобильной, авиационной промышленности, при производстве оборудования для пищевых предприятий. Кроме того, соединения алюминия применяют и в качестве пищевых добавок. При очистке водопроводной воды для осаждения частиц взвесей в качестве коагулянта. как правило, используют сульфат алюминия.
Несмотря на то, что алюминий широко применяется при производстве домашней посуды и оборудования для пищевых предприятий, данные о его содержании в пище и ежедневном потреблении с продуктами питания немногочисленны. Продукты растительного происхождения содержат алюминия, как правило, 10–100 мг/кг, редко – 300 мг/кг, продукты животного происхождения – 1–20 мг/кг. В природных водах он содержится в концентрации от 0,001 до 10 мг/л, в промышленных стоках его концентрация достигает 1000 мг/л.
Как установлено специалистами-токсикологами, растворимые соли алюминия отличаются слабым токсическим действием. При почечной недостаточности из-за накопления в организме алюминия возможны процессы нарушения метаболизма Ca, Mg и P. При значительном увеличении содержания AI в пищевых продуктах наблюдается нарушение речи и ориентации.
Обогащение пищи алюминием может происходить в процессе ее приготовления или хранения в алюминиевой посуде. Известно, что растворимость алюминия резко возрастает в щелочной и кислой средах. К веществам, усиливающим растворение алюминия, относятся антоциановые пигменты овощей и фруктов, анионы органических гидроокисей, поваренная соль. В процессе приготовления пищи, содержащей эти ингредиенты, в алюминиевой посуде концентрация алюминия в получаемых продуктах может увеличиться в несколько раз.
Нормативное содержание алюминия в пищевых продуктах составляет, мг/кг: в молочных продуктах – 1, в мясе, соках, напитках – 10, в хлебопродуктах, фруктах – 20, в овощах – 30. Концентрация алюминия 1,3–6,2 г/сутки является для человека смертельной.
Контрольные вопросы.
1.Какие элементы относятся к биогенными?
2. Какова металлы называют тяжелами?
3. В чем состоит избирательное накопление токсичных металлов внутренними органами?
4. Что означает ПДК тяжелых металлов в продуктах питания?
5. Как проявляется токсическое действие тяжелых металлов на организм человека?
 2015-04-30
2015-04-30 8432
8432
