Роль ферментов класса гидролаз в пищевых технологиях очень велика. Это находит отражение в специальной литературе, монографиях, технических инструкциях, стандартах. Поэтому в этом разделе остановимся на краткой характеристике наиболее важных представителей гидролитических ферментов. Для технологов наибольший интерес
представляют три подкласса ферментов класса гидролаз. Это ферменты, действующие на сложноэфирные связи — эстеразы (Н.Ф.3.1); действующие на гликозидные соединения — гликозидазы (Н.Ф.3.2) и действующие на пептидные связи — протеазы (Н.Ф.3.4).
Эстеразы (Н.Ф.3.1). Этот подкласс включает большое число ферментов (около 150), которые разделены на семь подподклассов: ферменты, действующие на эфиры карбоновых кислот (3.1.1); эстеразы тиоловых эфиров (3.1.2); гидролазы фосфорных моноэфиров или фосфатазы (3.1.3); гидролазы фосфорных диэфиров (3.1.4); гидролазы моноэфиров олигофосфорных кислот (3.1.5); сульфатазы (3.1.6); эстеразы моноэфиров дифосфорных кислот (3.1.7).
Наиболее важными с точки зрения участия в различных биохимических процессах, имеющих место при хранении и переработке пищевого сырья, являются ферменты подподкласса 3.1.1.
Липаза (Н.Ф.3.1.1.3). Липаза или триацилглицероллипаза широко распространена в природе и играет важную роль в процессах, протекающих при переработке и хранении пищевых продуктов. В настоящее время выделены и охарактеризованы липазы растительного происхождения (липаза клещевины, пшеницы и других злаков), животного (панкреатическая липаза, липаза молока) и микробного (бактериальные и грибные липазы).
Обычно липазы катализируют реакцию расщепления триглицеридов согласно приведенному ниже суммарному уравнению:
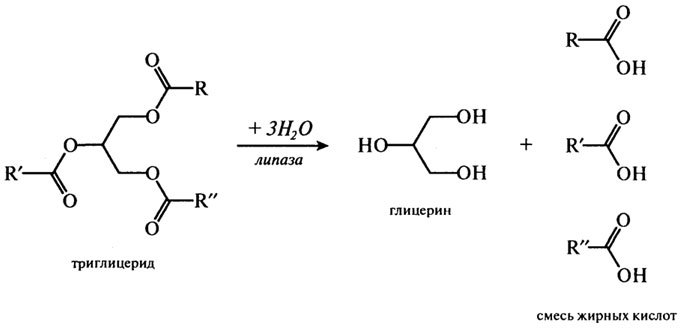
Причем предпочтительнее гидролизуются связи в положении 3 и 1 и лишь затем в положении 2. Многочисленные экспериментальные данные дают основание предположить следующий путь липолиза:
триглицерид → 1,2-диглицерид → 2-моноглицерид → глицерин
Установлено, что липазы быстрее отщепляют остатки высокомолекулярных жирных кислот, чем низшие карбоновые кислоты. Ферментативный гидролиз липидов имеет существенное отличие от других гидролитических реакций. Парадокс заключается в том, что липаза — водорастворимый фермент, а ее субстрат гидрофобен; однако активность липазы возрастает на границе "вода — липид". Этот феномен известен под названием "межфазная активация".
Липазы различного происхождения сильно отличаются друг от друга по специфичности действия, сродству к различным субстратам, растворимости, оптимуму рН и другим свойствам. Так, например, липаза семян клещевины нерастворима в воде, имеет оптимум рН 4,7 — 5,0; панкреатическая липаза растворима, и оптимум рН ее действия лежит в слабощелочной среде. Липазы микробного происхождения и липаза пшеничных зародышей также отличаются от липазы клещевины. Они растворимы в воде и имеют рН оптимум при 8,0. Липаза молока, молекулярная масса которой примерно 7000 Да, имеет оптимум рН 9,0 — 9,2 при гидролизе молочного жира.
Зерновая липаза участвует в процессе порчи зерновых продуктов при хранении. Особенно это касается продуктов, содержащих повышенное количество жира, например, овсяной муки или крупы, пшена. Накопление свободных жирных кислот под действием липазы (рост кислотного числа жира) — признак ухудшения качества продукта. Свободные жирные кислоты, особенно ненасыщенные, легко подвергаются окислению под воздействием разных факторов: липоксигеназы, тепловой обработки, кислорода воздуха, солнечного света и др. Таким образом, липазы могут инициировать процесс прогоркания и ограничивать сроки хранения пищевых продуктов.
Одна из особенностей липаз связана с тем, что эти ферменты способны катализировать и обратную реакцию, осуществлять синтез сложных эфиров, а также производить переэтерефикацию триглицеридов, т. е. изменять их жирнокислотный состав. На этом основании разрабатываются способы получения новых форм жировых продуктов с использованием специфических липаз. Так, например, путем реакции переэтерифи-кации делаются попытки получения жира — аналога масла какао из дешевого исходного сырья.
Пектинэстераза (Н.Ф.3.1.1.11). Пектинэстеразы синтезируются высшими растениями, микроскопическими грибами, дрожжами и бактериями. Пектинэстераза катализирует гидролиз сложноэфирных связей в молекуле растворимого пектина, в результате чего образуется метиловый спирт и полигалактуроновая кислота. Процесс протекает согласно следующей схеме (стрелками показано действие фермента):
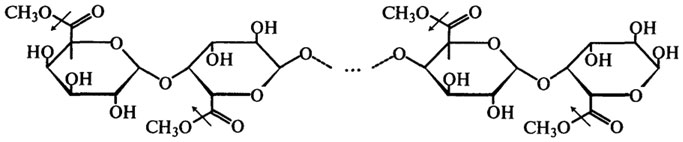
Таким образом, пектинэстераза отщепляет метоксильные группы от метоксилированной полигалактуроновой кислоты (см. также гл. Углеводы).
Желирующая способность пектина зависит от степени метоксилирования или степени этерификации, поэтому действие пектинэстеразы по отщеплению метоксильных групп приводит к снижению желирующей способности и сопровождается падением вязкости. На этом, очевидно, и основывается применение этого фермента для осветления плодовых соков и вина. Обычно комплексные препараты пектолитических ферментов, применяемые для этих целей, получают из различных плесневых грибов, и прежде всего из A. niger.
Гидролазы гликозидов или гликозидазы (Н.Ф.3.2). Этот подкласс включает около ста ферментов с разной специфичностью действия, осуществяющих гидролиз олиго- и полисахаридов; некоторые ферменты этого типа способны осуществлять трансферазные реакции — переносить гликозидные остатки на олиго- и полисахариды, наращивать полисахаридные цепочки. Представители гликозидаз были одними из первых ферментов, обратимость действия которых in vitro была экспериментально доказана.
Основной формой запасных углеводов в семенах и клубнях растений является крахмал. Ферментативные превращения крахмала лежат в основе многих пищевых технологий. Поэтому ферменты амилолитического комплекса растительного, животного и микробного происхождения интенсивно изучаются со времени их открытия Кирхгофом в 1814 г. и до настоящего времени.
α-Амилаза (Н.Ф.3.2.1.1). α-Амилазы обнаружены у животных (в слюне и поджелудочной железе), в растениях (проросшее зерно пшеницы, ржи, ячменя), они вырабатываются плесневыми грибами и бактериями. Все эти ферменты гидролизуют крахмал, гликоген и родственные α-1,4-глюканы с образованием, главным образом, декстринов и небольшого количества дисахарида — мальтозы.
α-Амилазы гидролизуют α-1,4-связи внутри молекулы крахмала, разрывая связь между первым углеродным атомом и кислородом, связывающим этот углерод с соседней молекулой глюкозы. Это наглядно демонстрирует следующая схема (стрелками показано действие фермента):
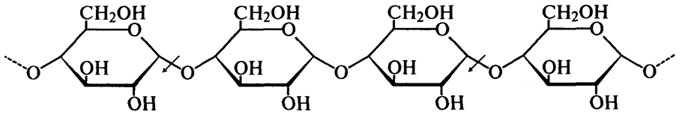
Скорость, с которой α-амилазы гидролизуют глюканы различной степени полимеризации, быстро уменьшается по мере ее снижения. Амилоза — линейная фракция крахмала, гидролизуется быстрее, чем амилопектин, имеющий разветвленную структуру.
Скорость гидролиза α-амилазой зависит от вида и состояния крахмала (нативный или клейстеризованный крахмал), а также от эффективности самих амилаз. На основании параллельно проводившихся опытов (в одних — действовали препаратами амилаз на клейстеризованный крахмал, а в других — эквивалентными концентрациями на нативные крахмальные зерна) было показано, что эффективность амилаз различного происхождения уменьшается в следующем порядке: панкреатическая, солодовая, бактериальная, грибная.
Характерной особенностью всех α-амилаз является наличие одного атома Са на молекулу фермента. Роль кальция состоит в том, что он стабилизирует вторичную и третичную структуру молекулы α-амилазы, обеспечивая таким образом ее каталитическую активность и вместе с тем предохраняя фермент от действия протеолитических ферментов и тепловой денатурации.
Различные α-амилазы отличаются по молекулярной массе, устойчивости к нагреванию и некоторым другим показателям. Молекулярная масса α-амилаз близка к 50 000 Да, за исключением бактериальной α-амилазы, которая имеет молекулярную массу 96 900 Да (кристаллический препарат). Так, например, широко применяемая в промышленности α-амилаза из плесневого гриба A. oryzae, полученная в кристаллическом виде, имеет молекулярную массу 51 860 Да.
Большое практическое значение имеет влияние температуры и рН на стабильность амилаз. Быстрое разрушение зерновой α-амилазы при рН 3,3 — 4,0, например, дает возможность выпекать ржаной хлеб из муки, которая содержит избыток α-амилазы, при низких значениях рН, чтобы предотвратить излишнее декстринирование крахмала и образование клейких веществ в мякише хлеба.
Говоря о термостабильности α-амилаз различного происхождения, можно расположить их в следующем ряду по мере снижения устойчивости к нагреванию: бактериальные амилазы — зерновые амилазы — грибные амилазы.
Последними работами в области изучения амилаз показано, что в семенах растений присутствуют два типа α-амилазы: α-амилаза созревания и α-амилаза прорастания.
В созревающем зерне синтезируется α-амилаза созревания, которая затем переходит в латентную форму, локализуясь на мембранах алейронового слоя. Первый этап гидролиза крахмала при прорастании осуществляется этой α-амилазой. И только на следующем этапе в работу включается вновь синтезируемый фермент — α-амилаза прорастания. Ее синтез в клетках зародыша и алейронового слоя начинается при влажности зерна выше 28%. Две формы α-амилазы семян злаков различаются по термостабильности: α-амилаза созревания при 70°С теряет 50% своей активности, тогда как α-амилаза прорастания при этой температуре только незначительно снижает свою активность.
Интенсивность гидролиза крахмала в перерабатываемом сырье, как уже отмечалось ранее, определяется взаимодействием многих факторов. Это прежде всего состояние амилаз созревшего зерна и возможность перехода части латентной формы в свободное состояние. Это и состояние субстрата, его доступность действию фермента (атакуемость субстрата). Большое значение имеет и фракционный состав крахмальных гранул, соотношение мелких и крупных зерен, а также содержание поврежденных зерен крахмала, которые легче поддаются действию ферментов.
Как было установлено в последнее время, важная роль в этом процессе принадлежит протеолитическим ферментам. Протеазы, осуществляя ограниченное расщепление белков, способствуют освобождению амилаз из связанного состояния, а также гидролизуют ту часть запасных белков, которая прочно связана с поверхностью крахмальных гранул, облегчая тем самым доступ фермента к субстрату.
Мощным механизмом регуляции скорости расщепления крахмальных гранул является система белковых ингибиторов амилаз, широко представленных в растениях. Ингибиторы белковой природы избирательно взаимодействуют с амилазами и образуют неактивные комплексы "амилаза — ингибитор". Высокой активностью обладают ингибиторы амилаз картофельного сока. Из зерна пшеницы выделен ингибитор с двумя активными центрами (двухцентровой). Один активный центр имеет сродство к протеазам и способен блокировать их действие. Другой активный центр имеет сродство к амилазам. Таким образом, один ингибитор белковой природы способен блокировать работу как протеаз, так и амилаз. В образующемся надмолекулярном комплексе ингибитор выполняет своеобразную роль связывающего звена, подавляя активность ферментов разного механизма действия.
β-Амилаза (Н.Ф.3.2.1.2). β-Амилаза отщепляет мальтозу от нередуцирующего конца цепи, разрывая гликозидные связи через одну. Название "|3-амилаза" было выбрано для того, чтобы показать, что мальтоза образуется в β-аномерной форме. Это не означает, что в молекуле крахмала присутствуют β- связи, а указывает скорее на то, что происходит инверсия конфигурации, которая может иметь место в процессе
ферментативного превращения вещества, содержащего асимметрический атом углерода. Такая инверсия была открыта П. Вальденом в 1893 г. и поэтому названа вальденовской инверсией. На представленной ниже схеме действие β-Амилазы на амилозу и амилопектин показано стрелками.
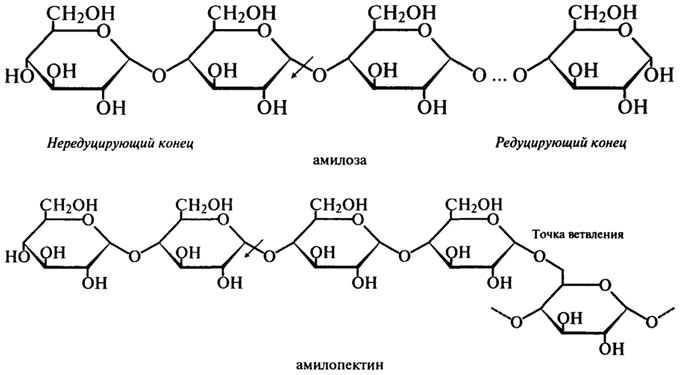
Таким образом, действуя упорядочение, β-Амилаза последовательно отщепляет остатки мальтозы с нередуцирующего конца до тех пор, пока не встретится точка ветвления со связью α-1,6. При этом амилоза под действием β-Амилазы расщепляется до мальтозы на 100%, а при действии β-Амилазы на амилопектин помимо образующейся мальтозы остается нетронутой крупная, сильно разветвленная сердцевина, так называемый "конечный декстрин", т. к. фермент прекращает свое действие за 2 — 3 остатка глюкозы от точек ветвления.
β-Амилазы — это ферменты в основном растительного происхождения. Хорошо известными источниками являются зерно пшеницы, а также пшеничный и ячменный солод, соевые бобы, клубни картофеля.
В отличие от α-амилазы, β-Амилаза менее термостабильна, но проявляет большую устойчивость к кислым значениям рН, сохраняя свою активность при рН 3,3. Это нашло свое отражение в способе разделения α-и β-Амилаз солода, где оба фермента присутствуют одновременно.
Глюкоамилаза (Н.Ф.3.2.1.3). Глюкоамилаза (у-амилаза) продуцируется различными видами плесневых грибов рода Aspergillus: A. oryzae, A. niger, A. awamory и некоторыми другими, например, Rhizopusdelamarn Rhizopus niveus. Эти ферменты расщепляют как амилозу, так и амилопектин до глюкозы, последовательно действуя с нередуцирующего конца цепи крахмала. Они способны гидролизовать α-1,4 и α-1,6 гликозидные связи.
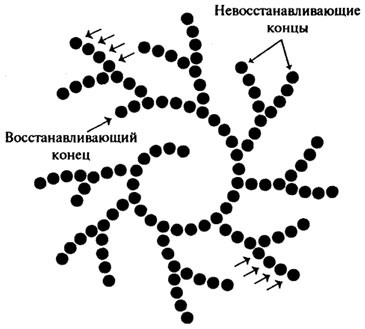
Различные глюкоамилазы отличаются друг от друга скоростью гидролиза крахмала, отношением к температуре и рН, и некоторыми другими показателями. На использовании препаратов грибной глюкоамилазы разработан ферментативный метод получения глюкозы, который получил широкое распространение в Японии.
Поллуланаза(Н.Ф. 3.2.1.41). Ранее этот фермент был известен под другими названиями — R-фермент, предельная декстриназа, дебранчинг-фермент.
Поллуланаза является эндогенным ферментом, она способна хаотично гидролизовать α-1,6-гликозидные связи в пуллулане, амилопектине, гликогене и предельных декстринах, которые получаются при совместном воздействии на крахмал и гликоген α- и β-Амилаз. Наиболее частым отцепляемым фрагментом является мальтотриоза. На представленной ниже схеме действие пуллулоназы на пуллулан показано стрелками.
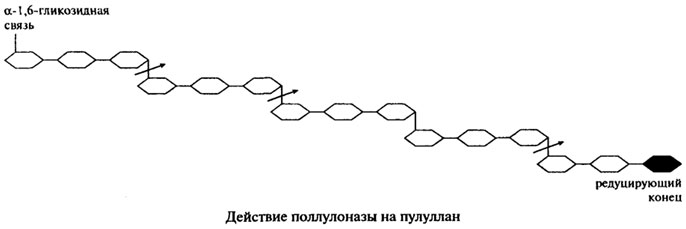
Продуцетами пуллуланазы являются Aerobacter aerogenes, Bacillus cereus, Bacillus polimyxa, Bacillus sp. и Streptomyces. Ферменты, полученные из различных источников, обладают разной молекулярной массой
(от 48 000 до 143 000 Да) и по разному относятся к температуре и рН, действию ингибиторов и активаторов.
Инулаза (Н.Ф. 3.2.1.7). Фермент осуществляет гидродиз инулина и других полифруктозанов по (3-1,2-фруктозидной связи, начиная с β-фруктозидного конца полимера. В результате образуется фруктоза и единственная молекула глюкозы на одну молекулу инулина. При полном гидролизе инулина получается 95% фруктозы и 5% глюкозы.
Фермент гидролизует главным образом инулин; сахароза, рафиноза также гидролизуются, но с незначительной скоростью. Инулаза содержится в тех же растениях (топинамбур, цикорий), в которых присутствует инулин. Активная инулаза продуцируется Aspergillus awamori BKM-808 при глубинном культивировании. Препарат обладает высокой стабильностью к Н+-ионам и температуре. Оптимум рН действия 4,5; оптимум температуры — 65°С.
Полученные из инулина фруктозные сиропы могут быть широко использованы в кондитерской промышленности и диетическом питании.
β-Фруктофуранозидаза (Н.Ф.3.2.1.26). Другие названия этого фермента — инвертаза или сахараза.
Для промышленного производства имеют значения только ферменты из S. cerevisiae и S. carlsbergensis. β-Фруктофуранозидазу выделяют из дрожжей путем автолиза. Этот фермент гидролизует сахарозу по β-фруктозидной связи согласно уравнению:
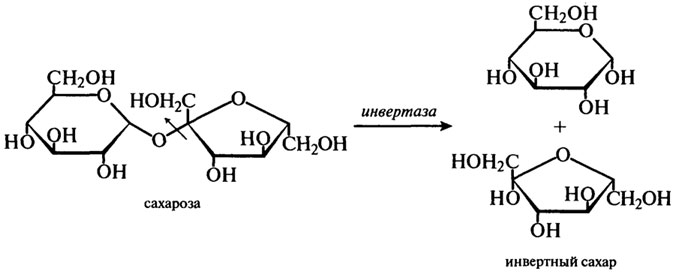
В результате действия фермента на сахарозу получается смесь эквимолярных количеств α-глюкозы и β-фруктозы, получившая название "инвертного сахара". Термин "инверсия" обозначает изменения, происходящие в способности сахара вращать плоскость поляризованного света. Это можно выразить следующей схемой:
Сахароза + Н2О → D (+)-глюкоза + D (—)-фруктоза
[α]D=+66,5° [ α]D = +52,5° [α]D = -92,4°
Оптимум рН дрожжевой инвертазы находится в достаточно широкой зоне от 4,0 до 5,5. Фермент ингибируется ионами металлов. Полное ингибирование происходит под действием ртути и свинца; частичное ингибирование вызывают ионы серебра, цинка, меди. β-Фруктофуранозидаза гидролизует также рафинозу и метил-β-О-фруктофуранозид, причем, если относительную скорость гидролиза сахарозы принять за 100, то соответствующие скорости расщепления этих субстратов будут равны 47 и 77.
Инвертаза находит широкое применение в пищевой промышленности. Гидролиз концентрированных растворов сахарозы приводит к образованию более сладких сиропов. Точка кипения инвертированных сиропов выше, а точка замерзания ниже, т. к. при инверсии повышается осмотическое давление. Образовавшиеся при действии инвертазы моносахариды более растворимы, не так легко выкристаллизовываются из высококонцентрированных сиропов. Практическое использование инвертазы в кондитерской промышленности будет рассмотрено в разделе 8.3.
β-Галактозидаза (Н.Ф.3.2.1.23). Фермент, который часто называют лактазой, катализирует реакцию гидролитического отщепления нередуцирующих остатков β-D-галактозы в β-галактозидах, в частности, в молочном сахаре — дисахариде лактозы:
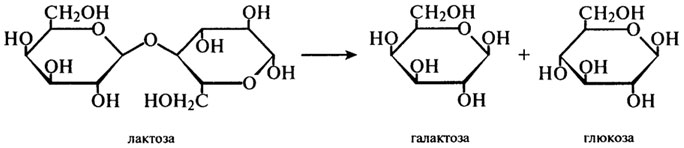
Ферментные препараты лактазы, применяемые в пищевой промышленности, получают с помощью различных продуцентов: микроскопических грибов (A. oryzae, A. niger), бактерий (Е. coli, Lactobacillus), дрожжей (S. fragilis, S. psedotropicalis). Все они имеют различные температурные оптимумы, которые, однако, лежат в пределах 37 — 50°С. Оптимумы рН этих ферментов также заметно отличаются: для бактериальных — около 7,0; для грибных — около 5,0; для дрожжевой лактазы — около 6,0.
При гидролизе лактозы в цельном молоке, обезжиренном молоке или в концентратах молока оптимальную активность (при нейтральном рН этих субстратов) проявляет дрожжевой фермент; для сыворотки и его концентратов — грибной. Причем в обезжиренном молоке или сыворотке лактоза гидролизуется легче, чем в цельном, а пастеризованные субстраты гидролизуются легче, чем непастеризованные.
β-Галактозидаза из E.coli была получена в кристаллическом состоянии, ее молекулярная масса 850 000 Да. Она ингибируется некоторыми металлами (Си, Zn). Восстанавливающие агенты (цистеин, сульфид Na, сульфит Na и др.) активируют фермент и способны преодолевать влияние ингибиторов-металлов.
У некоторых групп населения (исключение составляют жители Северной Европы и некоторых районов Африки) ярко выражена непереносимость (интолерантность) лактозы, связанная с полным или частичным исчезновением у взрослых людей лактазной активности в клетках кишечного эпителия. У грудных младенцев активность этого фермента очень высока.
Эндополигалактуроназа (Н.Ф.3.2.1.15) и экзополигалактуроназа (Н.Ф.3.2.1.67). Эти два фермента участвуют в превращениях пектиновых веществ наряду с другими пектолитическими ферментами растительного и микробного происхождения (см. также гл. 3).
Эндополигалактуроназа — фермент, который гидролизует α-1,4-связи в молекуле растворимого пектина (метоксилированной полигалактуроновой кислоты), неупорядоченным, произвольным образом. С возрастанием степени этерификации полигалактуроновой кислоты степень и скорость гидролиза падают, т. к. для проявления каталитической активности фермента требуются свободные карбоксильные группы. Большинство изученных эндополигалактуроназ микроскопических грибов имеют молекулярную массу от 30 000 до 40 000 Да. Оптимальные значения рН колеблются в диапозоне 3,8 — 5,5.
В гидролизе этого типа связи принимает участие и другой фермент — экзополигалактуроназа, который последовательно отщепляет молекулу галактуроновой кислоты, начиная с нередуцирующего конца. Эндополигалактуроназа синтезируется как грибами, так и некоторыми видами бактерий. Они отличаются по своей специфичности к пектинам из различных источников, конечными продуктами реакции, оптимуму рН и другим свойствам.
Для промышленного производства ферментных препаратов пек-толитических ферментов, которые являются комплексными, в качестве продуцентов используют в основном микроскопические (плесневые) грибы, в частности, грибы рода Aspergillus: A. niger, A. wentii, A. oryzae. Бактериальные ферменты в промышленных масштабах не производятся.
Растительные полигалактуроназы, по-видимому, похожи на грибные прлигалактуроназы. Они обнаружены в широком спектре плодов и овощей: помидорах, авокадо, редисе, огурцах, яблоках, грушах, цитрусовых и др. Все они проявляют активность при естественных рН плодов.
Применение препаратов пектолитических ферментов в промышленности достаточно обширно. Они используются при производстве фруктовых соковых концентратов и экстрактов, при осветлении соков и вин, при производстве фруктовых и овощных пюре и нектаров.
Целлюлолитические ферменты. Ферментативное разрушение целлюлозы и родственных ей полисахаридов (гемицеллюлозы, лигнина) — сложный процесс, требующий участия комплекса ферментов. Продуцентами такого комплекса целлюлолитических ферментов являются грибы рода Trichoderma, Phanerochaete (Sporotrichum) и Fusarium, a также бактерии рода Clostridium, Cellulomonas и некоторые другие.
Три основных типа целлюлолитических ферментов, продуцируемых микроскопическими грибами, образуют комплекс ферментов, способных осуществить полный гидролиз целлюлозы:
— Эндо-1,4-β-глюконаза или целлюлаза (Н.Ф.3.2.1.4) беспорядочно гидролизует β- 1,4-гликозидные связи. Она не расщепляет целлобиозу, но гидролизует целлодекстрины и производные целлюлозы с высокой степенью замещения, т. к. специфичность этого фермента не высока.
— Экзо-1,4-β-глюконаза или целлобиогидролаза (Н.Ф.3.2.1.91) действует на целлюлозу, отщепляя целлобиозные звенья с нередуцирующего конца цепи. Этот фермент не действует на замещенные производные целлюлозы, что указывает на более высокую субстратную специфичность, чем у эндоглюконазы. Целлобиогидролаза гидролизует целлодекстрины, но не действует на целлобиозу.
— β-Глюкозидаза (Н.Ф.3.2.1.21) расщепляет целлобиозу и целлоолигосахариды до глюкозы. Фермент не действует на целлюлозу и высшие олигосахариды.
Целлюлазная система бактерий существенно проще, чем у грибов, т. к. бактерии образуют только эндоглюконазу и β-глюкозидазу.
Все ферменты целлюлолитического комплекса достаточно хорошо изучены: практически все они являются гликопротеидами, определены их молекулярные массы, изоэлектрические точки, для многих показано наличие множественных форм.
Доказано, что различные ферменты, гидролизующие высокоупорядоченную целлюлозу, действуют в синергизме (рис. 8.10).
Эндоглюконаза атакует аморфные участки целлюлозных фибрилл. В результате образуются новые целлюлозные цепочки, на которые действует целлобиогидролаза, отщепляя целлобиозные звенья с нередуцирующего конца. Синергизм между двумя этими ферментами проявляется в том, что в результате действия эндоглюконазы появляется новый субстрат (более короткие цепочки), на который действует уже целлобиогидролаза. β-Глюкозидаза усиливает гидролиз, расщепляя целлобиозу — конечный продукт и ингибитор этих ферментов.

Рис. 8.10. Схема ферментативного гидролиза целлюлозы
Применение целлюлолитических ферментов представляет большой интерес, т. к. ферментативный гидролиз целлюлозосодержащих материалов (древесина, торф, сельскохозяйственные и городские отходы) может обеспечить получение различных биотехнологических продуктов (глюкозы, этанола, ацетона, микробной биомассы). В настоящее время исследования ферментативного расщепления целлюлозы достигли такого уровня, когда имеются все необходимые условия для разработки промышленного процесса и лишь по экономическим причинам он не реализуется на практике.
Протеолитические ферменты (Н.Ф.3.4). Основной реакцией, катализируемой протеолитическими ферментами, является гидролиз пептидной связи в молекулах белков и пептидов.
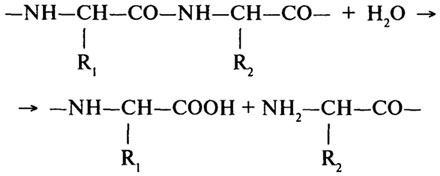
Согласно первоначальной классификации протеолитических ферментов их делили на две группы: протеиназы и пептидазы. При этом считали, что протеиназы действуют на белки, расщепляя их до полипептидов; полипептиды же гидролизуются пептидазами до аминокислот. Более поздняя классификация, до сих пор сохранившая свое значение, основана на схеме, предложенной М. Бергманом и Д. Фрутоном (1937). Согласно этой схеме протеазы разделяются на эндо- и экзопептидазы. Ферменты первой группы (эндопептидазы) могут гидролизовать глубинные пептидные связи и расщеплять молекулу белка на более мелкие фрагменты; ферменты второй группы (экзопептидазы) не могут гидролизовать пептидные связи, находящиеся в середине цепи, и действуют либо с карбоксильного, либо с аминного конца цепи, отщепляя последовательно одну задругой концевые аминокислоты. В связи с этим экзопептидазы подразделяют на аминопептидазы, карбоксипептидазы и дипептидазы.
Аминопептидазы (Н.Ф.3.4.11) катализируют отщепление N-концевых аминокислот.
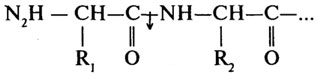
Карбоксипептидазы (Н. Ф. 3.4.12) катализируют отщепление С-концевых аминокислот.
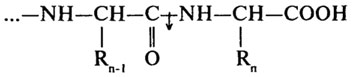
Дипептидазы (Н.Ф.3.4.13) проявляют специфичность к дипептидным субстратам.
Вместе с тем эндопептидазы (протеиназы) разделены на подгруппы, начиная с подподкласса 3.4.21, в первую очередь на основании
каталитического механизма (строения активного центра); особенности специфичности используются при этом только для идентификации индивидуальных ферментов в пределах подподкласса:
— сериновые протеиназы (Н.Ф.3.4.21), в активном центре которых функционирует остаток серина и гистидина;
— тиоловые (цистеиновые) протеиназы (Н.Ф.3.4.22), содержат в активном центре SH-группу остатка цистеина;
— кислые (карбоксильные) протеиназы (Н.Ф.3.4.23), в активном центре содержат СООН-группу остатка аспарагиновой кислоты;
— металлопротеиназы (Н.Ф.3.4.24), содержат в активном центре металл, необходимый для проявления их каталитической активности.
Группа протеиназ, о механизме действия которых ничего неизвестно, отнесена к подподклассу 3.4.99.
Субстратная специфичность протеиназ будет определяться следующими факторами: природой аминокислоты, образующей гидролизуемую пептидную связь; радикалами аминокислот, удаленными от гидролизуемой пептидной связи; общей пространственной конформацией молекулы белка, делающей определенные пептидные связи доступными для действия фермента.
Исследование протеолитических ферментов ведется весьма интенсивно. Это происходит вследствие того, что они являются чрезвычайно удобным объектом для изучения структуры белков, активных центров ферментов, механизмов регуляции ферментативной активности и других важных вопросов энзимологии; кроме того, протеазы широко применяются в различных отраслях промышленности: пищевой, сельском хозяйстве, медицине.
Промышленное применение препаратов протеаз будет описано в разделе 8.3. Здесь же мы остановимся на рассмотрении отдельных свойств протеаз, имеющих технологическое значение, предварительно разделив их по типу происхождения на растительные, животные и микробные.
Растительные протеазы. Споры о приоритетности тех или иных ферментных препаратов, полученных из названных источников, ведутся уже достаточно долго. Однако, в связи с ограниченностью животного сырья (внутренние органы крупного рогатого скота и свиней), а также возможной токсичностью микробных препаратов (все они требуют высокой степени очистки, хотя и это не может служить абсолютной гарантией их безопасности), большой интерес представляют растительные протеазы, лишенные указанных недостатков.
Папаин (Н.Ф.3.4.22.2) и химопапаин (Н.Ф.3.4.22.6). Папаин является наиболее применяемым в производстве протеолитическим ферментом. Ферменты папаин и химопапаин — истинные ферменты латекса плодов дынного дерева (Carica papaya).
Эти ферменты относятся к группе тиоловых протеиназ, характерной особенностью которых является то, что они активируются сульфгидрильными соединениями — восстановленным глутатионом, цистеином.
Папаин и химопапаин получены в кристаллическом состоянии; их молекулярная масса 20 700 и 36 000 Да, соответственно, а изоэлектрические точки равны 8,75 для папаина и 10,1 для химопапаина.
Оптимальная зона рН для действия папаина зависит от природы гидролизуемого белка и может быть слабокислой, нейтральной или слабощелочной.
Химопапаин имеет большое сходство с папаином, однако можно выделить и некоторые интересные отличия. Например, активность химопапаина при гидролизе гемоглобина и казеина в два раза ниже, чем у папаина; он более термоустойчив, чем папаин, и проявляет хорошую стабильность в кислой среде (рН 2,0).
Папаин обладает довольно широкой специфичностью. Он преимущественно гидролизует вторую пептидную связь, лежащую за карбоксильной группой фенилаланина.
Различные фирмы, как зарубежные, так и отечественные, выпускают ферментные препараты на основе папаина с различной степенью очистки. Возможности их использования обширны: кожевенная промышленность (при обезволашивании и мягчении шкур); кинопроизводство (для растворения желатинового слоя на пленках при их регенерации); парфюмерия (при создании добавок в кремы, лосьоны, зубные пасты); производство синтетических моющих средств (для удаления загрязнений белковой природы); медицина (при лечении воспалительных процессов, ожогов, тромбозов и др.); пищевая промышленность (виноделие, пивоварение, производство спирта, хлебопечение, сыроделие и др.).
Фицин (Н. Ф. 3.4.22.3) и бромелаин (Н. Ф. 3.4.22.5). Фицин выделяют из млечного сока фикусовых растений, например, инжира (Ficus carica). Так же, как и папаин, он относится к тиоловым протеиназам. Еще один тиоловый фермент — бромелаин — получают из свежего сока ананаса (Bromeliacea).
Оба эти фермента имеют сходство с папаином, проявляют наибольшую активность в нейтральной зоне рН, обладают широкой специфичностью, предпочтительно расщепляют пептидные связи, образованные положительно заряженными аминокислотами.
Использование бромелаина и фицина аналогично использованию папаина; в последние годы их производство возросло, и в настоящее время эти ферменты применяют для удаления белковой мути в пиве и для мягчения мяса.
Протеолитические ферменты семян растений. В семенах злаковых и бобовых культур содержится целый комплекс
протеолитических ферментов, участвующих в расщеплении запасных белков до аминокислот в процессе прорастания семян. В покоящихся семенах состояние белкового комплекса характеризуется высокой стабильностью и автолиз в водных суспензиях выражен слабо. Поэтому комплекс протеолитических ферментов семян оставался долгое время слабо изученным. Это было связано с методическими трудностями их выделения и очистки. В настоящее время известно, что протеолиз белков в семенах растений осуществляется комплексом ферментов, различающихся по своим функциям, механизму действия и другим показателям. Некоторые из этих ферментов были выделены в виде высокоочищенных препаратов и подробно охарактеризованы. Так, например, из семян пшеницы были выделены несколько типов протеолитических ферментов, различающихся по оптимуму рН: кислые протеиназы с оптимумом рН 3,7 — 4,0; нейтральные протеиназы с оптимумом рН 6,5 — 7,0; щелочные протеиназы с оптимумом рН > 8,0.
Из трех групп протеиназ наибольшего внимания технологов заслуживают нейтральные протеиназы. По активности они в несколько раз превосходят кислые и в условиях теста способны эффективно расщеплять белки клейковины. Одна из особенностей нейтральных протеиназ состоит в том, что они не растворяются в водных, солевых и буферных растворах. Они прочно связаны с белками клейковинного комплекса и извлекаются при частичном растворении клейковины в щелочном растворе. Максимальное извлечение нейтральных протеиназ происходит при обработке измельченного зерна, муки или лиофилизированной клейковины 0,35%-м раствором карбоната натрия. При подкислении щелочного раствора нейтральные протеиназы выпадают в осадок, а в надосадочной жидкости остаются их белковые ингибиторы. Таким образом, в созревших семенах пшеницы нейтральные протеиназы и их белковые ингибиторы образуют единый неактивный комплекс, связанный с клейковиной. Соотношение активности протеиназ и их ингибиторов в созревшем зерне определяет стабильность белкового комплекса, его устойчивость в процессе тестоведения.
Нейтральные протеиназы не активируются восстановленным глутатионом или цистеином и поэтому не могут быть отнесены к тиоловым ферментам, в отличие от кислых протеиназ. Нейтральные протеиназы ингибируются хлоридом натрия, фенольными соединениями, ароматическими аминокислотами, продуктами сахаро-аминной реакции (меланоидинами). Хлорид натрия является обязательным компонентом рецептуры и, внесенный в таком количестве, снижает активность нейтральных протеиназ и соответственно интенсивность автолиза на 60 — 70%. В зависимости от качества муки и состояния ее клейковинного комплекса технолог может варьировать время внесения соли и тем самым
регулировать интенсивность протеолиза. При переработке слабой муки необходимо как можно раньше вводить соль, тогда как для муки с чрезмерно крепкой клейковиной желательно активизировать протеолиз, и соль следует вносить на более поздних стадиях.
В связи с этим необходимо еще раз подчеркнуть важность изучения собственных эндогенных ферментных систем биологического сырья, факторов, влияющих на их активность с точки зрения их огромной роли в процессах, происходящих при созревании, хранении и переработке пищевого сырья.
Протеазы животного происхождения. Протеазам животного происхождения принадлежит огромная роль в процессах пищеварения. Они были одними из первых ферментов, которые получены в высокоочищенном кристаллическом состоянии и детально изучены. Именно они стали объектами для расшифровки структуры активного центра и механизма каталитической активности. Кроме того, эти ферменты, благодаря своей высокой специфичности, сами явились инструментами для расшифровки первичной структуры белков, изучения регуляторных функций протеаз в метаболизме клетки.
Трипсин (Н.Ф.3.4.21.4). Трипсин — сериновая протеиназа, полученная в кристаллической форме. Молекулярная масса около 23 800 Да. Изо-электрическая точка 10,6; оптимум рН действия находится между 7,0 — 9,0 для белков и синтетических субстратов.
Трипсин проявляет высокую специфичность к определенным пептидным связям. Он осуществляет гидролиз пептидных связей, образованных карбоксильными группами аргинина и лизина. Трипсин секретируется поджелудочной железой в виде зимогена — трипсиногена, неактивного предшественника, и активируется либо энтерокиназой, либо аутокаталитически активным трипсином по механизму ограниченного протеолиза. Превращение трипсиногена (229 аминокислотных остатка и молекулярная масса около 24 000 Да) в трипсин (223 аминокислотных остатка) можно представить следующим образом: разрыв одной-единственной пептидной связи между Лиз — Иле, отщепление N-концевого гексапептида Вал — Асп — Асп — Асп — Асп — Лиз приводит к образованию активной формы фермента.
Высокоочищенный трипсин применяется для медицинских целей. Это одна из главных протеаз поджелудочной железы, которая в виде неочищенного панкреатина находит некоторое применение в пищевой промышленности для производства гидролизатов.
Химотрипсин (Н.Ф.3.4.21.1). Химотрипсин — протеолитический фермент, секретируемый поджелудочной железой в тонкий кишечник в виде неактивного предшественника, называемого химотрипсиногеном. Химотрипсиноген (молекулярная масса около 25 000 Да) представляет собой
полипептидную цепь, состоящую из 245 аминокислотных остатков и содержащую пять дисульфидных связей. Он активируется в тонком кишечнике под действием трипсина. При этом происходит гидролиз четырех пептидных связей и отщепление двух дипептидов(14 — 15 и 147 — 148). В результате образуется активный химотрипсин, состоящий из трех полипептидных цепей, ковалентно связанных двумя дисульфидными мостиками.
В активном центре химотрипсина содержится остаток гистидина (57), аспарагиновой кислоты (102) и остаток серина (195). Молекулярная масса около 22 500 Да. Изоэлектрическая точка 8,3; оптимум рН в пределах 7,0 — 9,0, что согласуется с естественными условиями его действия.
Специфичность химотрипсина заключается в том, что он предпочтительнее гидролизует пептидные связи, образованные ароматическими аминокислотами: тирозином, триптофаном, фенилаланином.
Этот фермент не применяется в пищевой промышленности как таковой, но является составной частью комплексных препаратов панкреатина.
Пепсин (Н.Ф.3.4.23.1). Пепсин вырабатывается слизистой желудка в виде пепсиногена (молекулярная масса около 42 000 Да). Пепсиноген превращается в активный пепсин под действием НС1 или аутокаталитически путем расщепления одной пептидной связи. Фермент получен в кристаллическом виде, его молекулярная масса 35 000 Да, оптимум рН действия 1,8.
Пепсин является кислой (карбоксильной) протеиназой. Его специфичность выражается в преимущественном гидролизе пептидных связей, образованных аминными группами фенилаланина и тирозина.
Пепсин имеет огромное значение как пищеварительный фермент, он входит в состав лекарственных ферментных препаратов, тонизирующих средств, жевательной резинки. В пищевой промышленности пепсин используют для свертывания казеина молока и для растворения белковой мути в пиве.
Реннин (Н.Ф.3.4.23.4). Этот фермент, имеющий много сходства с пепсином, содержится в соке четвертого отдела желудка телят. Реннин образуется из предшественника — прореннина. Его молекулярная масса около 40 000 Да, изоэлектрическая точка около 4,5. Оптимум рН действия фермента 3,7.
Реннин представляет собой мощную протеазу, осуществляющую свертывание молока; он является основным компонентом неочищенных экстрактов и комплексных промышленных препаратов, используемых для этой цели.
Казеин молока (78% всех азотистых веществ молока) является фос-фопротеидом, содержащим около 6-10% углеводов. Он не осаждается ионами Са+2; действие реннина приводит к образованию макроглико-пептида и парα-х-казеина. Последний осаждается в присутствии ионов Са+2 и способствует осаждению других фракций казеина.
Микробные протеазы. Число микроорганизмов, продуцирующих протеазы, чрезвычайно велико. Специфичность этих ферментов во многих случаях более широкая, чем специфичность хорошо изученных ферментов животного происхождения, что затрудняет их классификацию.
Микробные протеазы (грибные и бактериальные) находят широкое применение в различных отраслях промышленности. Среди них есть ферменты, имеющие оптимумы в нейтральной, кислой и щелочной зонах рН; некоторые из них проявляют трипсиноподобное действие, другие являются пепсиноподобными ферментами, третьи — тиоловыми, четвертые имеют пептидазную активность и т. д. Многие из них были выделены в виде высокоочищенных препаратов и подробно охарактеризованы.
Наибольшее применение нашли щелочная сериновая протеаза из Bacillus licheniformis, которая используется в моющих средствах; протеаза из Мусог, которая заменила телячьи сычуги в производстве сыра, а также грибная протеаза из A. oryzae (в комплексе с амилазой), используемая в хлебопечении.
Протеазы — наиболее важные промышленные ферменты. Уровень потребления препаратов микробных протеаз около 40% от всех используемых ферментов (табл. 8.3).
Таблица 8.3. Уровень потребления промышленных препаратов протеаз [Микробные ферменты и биотехнология (под ред. В. М. Фогарти), 1986]
| Фермент | Доля проданных на рынке микробных протеаз, % | |
| Микробные ферменты | Всего ферментов | |
| Бактериальная щелочная протеаза | ||
| Микробный реннин | ||
| Другие микробные протеазы | 3,5 | |
| Животный реннин | — | |
| Другие протеазы животного происхождения | — | 2,5 |
| Растительные протеазы | — | |
| Другие (непротеолитические) микробные ферменты | ||
| Всего | 100 | 100 |
Субтилизин Карлсберга (Н.Ф.3.4.21.14). Кристаллическая форма этого фермента впервые была получена в 1952 г., и с тех пор субтилизин является наиболее важной промышленно используемой микробной протеазой. Он продуцируется В. subtilis и В. licheniformis.
Этот фермент состоит из одной полипептидной цепочки (214 аминокислотных остатка), среди аминокислот отсутствует цистеин. Молекулярная масса фермента — 27 277 Да, изоэлектрическая точка 9,4; оптимум рН 8,0 — 9,0. Фермент отличается высокой рН-стабильностью в диапазоне от 5,0 до 11,0.
Субтилизин Карлсберга является сериновой протеиназой, обладает широкой специфичностью, предпочтительнее гидролизует пептидные связи, образованные ароматическими аминокислотами.
Ренниноподобные кислые протеазы. Наиболее важные с практической точки зрения кислые протеазы, используемые при производстве сыров, образуют культуры Mucor pusillus и Mucor mieher.
Протеазы из Mucor pusillus имеют молекулярную массу 30 000 Да, состоят из одной полипептидной цепочки, оптимум рН действия по казеину 4,5, по гемоглобину 4,0.
Протеазы из Mucor mieher имеют большую молекулярную массу 38 000 Да, содержат около 6% углеводов и проявляют максимальную активность по гемоглобину при рН 4,5.
Нейтральные протеазы аспергилловых грибов. Из культуры A. oryzae были выделены две нейтральные металлопротеиназы. Одна из них имеет оптимум рН 7,0, однако быстро инактивируется при 50°С. Другая обладает более низким оптимумом рН 5,5 — 6,0, но проявляет высокую термостабильность (10 минут, 90°С — остаточная активность 10%).
Протеазы из различных штаммов A. oryzae или из одних штаммов, но растущих при разных условиях, неодинаково влияют на процесс хлебопечения даже в том случае, если доза фермента стандартизирована. Это объясняется тем, что промышленные препараты содержат различные количества протеолитических компонентов из A. oryzae, а также влиянием многообразных внешних и внутренних факторов на протеолиз белков муки.
303:: 304:: 305:: 306:: 307:: 308:: 309:: 310:: 311:: 312:: 313:: 314:: 315:: 316:: 317:: 318:: 319:: 320:: 321:: 322:: 323:: Содержание
323:: 324:: Содержание
8.3. ПРИМЕНЕНИЕ ФЕРМЕНТОВ В ПИЩЕВЫХ
ТЕХНОЛОГИЯХ
Ферментные препараты в отличие от ферментов содержат помимо активного фермента множество балластных веществ, в том числе и других белков. Кроме того, большинство ферментных препаратов являются комплексными, т. е. кроме основного фермента, имеющего наибольшую активность, в его состав входят другие сопутствующие ферменты. Однако существуют препараты и индивидуальных ферментов.
Название ферментного препарата включает название основного фермента и название микроорганизма-продуцента, с окончанием "-ин". Например: амилоризин — основной фермент — амилаза, продуцент
Aspergillus oryzae; протосубтилин — основной фермент — протеаза, продуцент Bacillus subtilis. Помимо этого, в названии обязательно отражается способ культивирования микроорганизма: Г — глубинное; П — поверхностное, а также степень очистки — X (2Х; ЗХ; 10Х; 15Х; 20Х).
Применение ферментных препаратов в отраслях пищевой промышленности позволяет интенсифицировать технологические процессы, улучшать качество готовой продукции, увеличивать ее выход, а также сэкономить ценное пищевое сырье.
Ферментные препараты должны удовлетворять требованиям, предъявляемым конкретными технологиями не только по типу катализируемой реакции, но и в отношении условий их действия: рН, температуры, стабильности, присутствия активаторов и ингибиторов, т. е. тех факторов, которые обуславливают эффективность действия препарата в данной среде и позволяют правильно определить технологические режимы его применения.
В зависимости от цели применения к ферментным препаратам предъявляются определенные требования не только в отношении состава ферментов и оптимальных условий их действия, но и в отношении степени очистки, применяемых наполнителей, стоимости и ряда других параметров.
Очень важным моментом является оценка безопасности ферментных препаратов, и в первую очередь это касается микробных ферментных препаратов, которые требуют тщательного химического, микробиологического и токсикологического контроля. Особое место занимают ферментные препараты, получаемые из генетически модифицированных микроорганизмов. Основными ферментными препаратами, полученными методами генной инженерии и разрешенными к применению в пищевой промышленности, являются: α-амилаза из В. stearothermophilys, экспрессированная в В. subtilis; α-амилаза из В. megaterium, экспрессированная в В. subtilis; химозин А, полученный из штамма Е. coli К-12, содержащего ген телячьего прохимозина А.
В настоящее время в мире производится большое количество ферментных препаратов для разных отраслей пищевой промышленности, применяемых на различных стадиях технологического процесса. Различные фирмы выпускают ферментные препараты под разными коммерческими (торговыми) названиями. Однако работа по поиску новых продуцентов, созданию новых препаратов пролонгированного действия, очистке ферментных препаратов, повышению их стабильности и т. п. ведется весьма интенсивно.
323:: 324:: Содержание
324:: 325:: 326:: Содержание
 2015-09-06
2015-09-06 6550
6550
