Гликолиз стимулируется инсулином, повышающим количество молекул гексокиназы, фосфофруктокиназы, пируваткиназы.
В печени активность глюкокиназы регулируется гормонами: активацию вызывает инсулин и андрогены, подавляют ее активность глюкокортикоиды и эстрогены.
Для метаболической регуляции чувствительной является фосфофруктокиназа. Она активируется АМФ и собственным субстратом, ингибируется – АТФ, лимонной кислотой, жирными кислотами. Пируваткиназа активируется фруктозо-1,6-дифосфатом. Гексокиназа непеченочных клеток ингибируется продуктом собственной реакции – глюкозо-6-фосфатом.
17. Аэробный распад глюкозы: последовательность реакций, физиологическое значение. Роль аэробного распада глюкозы в мышцах при мышечной работе. Роль аэробного распада глюкозы в мозге.
Аэробным гликолизом называют процесс окисления глюкозы до пировиноградной кислоты, протекающий в присутствии кислорода. Все ферменты, катализирующие реакции этого процесса, локализованы в цитозоле клетки. В аэробном гликолизе можно выделить 2 этапа.
1. Подготовительный этап, в ходе которого глюкоза фосфорилируется и расщепляется на две молекулы фосфотриоз. Эта серия реакций протекает с использованием 2 молекул АТФ.
2. Этап, сопряжённый с синтезом АТФ. В результате этой серии реакций фосфотриозы превращаются в пируват. Энергия, высвобождающаяся на этом этапе, используется для синтеза 10 моль АТФ.
Реакции аэробного гликолиза:
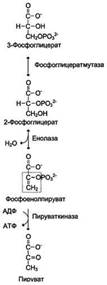
 1) Превращение глюкозо-6-фосфата в 2 молекулы глицеральдегид-3-фосфата. Глюкозо-6-фосфат, образованный в результате фосфорилирования глюкозы с участием АТФ, в ходе следующей реакции превращается в фруктозо-6-фосфат. Эта обратимая реакция изомеризации протекает под действием фермента глюкозофосфатизомеразы. Затем следует ещё одна реакция фосфорилирования с использованием фосфатного остатка и энергии АТФ. В ходе этой реакции, катализируемой фосфофруктокиназой, фруктозо-6-фосфат превращается в фруктозо-1,6-бисфосфат. Данная реакция, так же, как гексокиназная, практически необратима, и, кроме того, она наиболее медленная из всех реакций гликолиза. Реакция, катализируемая фосфофруктокиназой, определяет скорость всего гликолиза, поэтому, регулируя активность фосфофруктокиназы, можно изменять скорость катаболизма глюкозы. Фруктозо-1,6-бисфосфат далее расщепляется на 2 триозофосфата: глицеральдегид-3-фосфат и дигидроксиацетонфосфат. Реакцию катализирует фермент фруктозобисфосфатальдолаза, или просто альдолаза. Этот фермент катализирует как реакцию альдольного расщепления, так и альдольной конденсации, т.е. обратимую реакцию. Продукты реакции альдольного расщепления - изомеры. В последующих реакциях гликолиза используется только глицеральдегид-3-фосфат, поэтому дигидроксиацетонфосфат превращается с участием фермента триозофосфатизомеразы в глицероальдегид-3-фосфат.
1) Превращение глюкозо-6-фосфата в 2 молекулы глицеральдегид-3-фосфата. Глюкозо-6-фосфат, образованный в результате фосфорилирования глюкозы с участием АТФ, в ходе следующей реакции превращается в фруктозо-6-фосфат. Эта обратимая реакция изомеризации протекает под действием фермента глюкозофосфатизомеразы. Затем следует ещё одна реакция фосфорилирования с использованием фосфатного остатка и энергии АТФ. В ходе этой реакции, катализируемой фосфофруктокиназой, фруктозо-6-фосфат превращается в фруктозо-1,6-бисфосфат. Данная реакция, так же, как гексокиназная, практически необратима, и, кроме того, она наиболее медленная из всех реакций гликолиза. Реакция, катализируемая фосфофруктокиназой, определяет скорость всего гликолиза, поэтому, регулируя активность фосфофруктокиназы, можно изменять скорость катаболизма глюкозы. Фруктозо-1,6-бисфосфат далее расщепляется на 2 триозофосфата: глицеральдегид-3-фосфат и дигидроксиацетонфосфат. Реакцию катализирует фермент фруктозобисфосфатальдолаза, или просто альдолаза. Этот фермент катализирует как реакцию альдольного расщепления, так и альдольной конденсации, т.е. обратимую реакцию. Продукты реакции альдольного расщепления - изомеры. В последующих реакциях гликолиза используется только глицеральдегид-3-фосфат, поэтому дигидроксиацетонфосфат превращается с участием фермента триозофосфатизомеразы в глицероальдегид-3-фосфат.
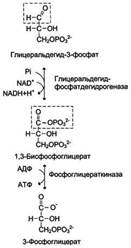
2) Превращение глицеральдегид-3-фосфата в пируват. Эта часть аэробного гликолиза включает реакции, связанные с синтезом АТФ. Наиболее сложной в данной серии реакций является реакция превращения глицеральдегид-3-фосфата в 1,3-бисфосфоглицерат. Это превращение - первая реакция окисления в ходе гликолиза. Реакцию катализирует глицеральдегид-3-фосфатдегидрогеназа, которая является NAD-зависимым ферментом. Значение данной реакции заключается не только в том, что образуется восстановленный кофермент, окисление которого в дыхательной цепи сопряжено с синтезом АТФ, но также и в том, что свободная Е окисления концентрируется в макроэргической связи продукта реакции. Глицеральдегид- 3 -фосфатдегидрогеназа содержит в активном центре остаток цистеина, сульфгидрильная группа которого принимает непосредственное участие в катализе. Окисление глицеральдегид-3-фосфата приводит к восстановлению NAD и образованию с участием Н3РО4 высокоэнергетической ангидридной связи в 1,3-бисфосфоглицерате в положении 1. В следующей реакции высокоэнергетический фосфат передаётся на АДФ с образованием АТФ. Фермент, катализирующий это превращение, назван по обратной реакции фосфоглицераткиназой. Образование АТФ описанным способом не связано с дыхательной цепью, и его называют субстратным фосфорилированием АДФ. Образованный 3-фосфоглицерат уже не содержит макроэргической связи. В следующих реакциях происходят внутримолекулярные перестройки, смысл которых сводится к тому, что низкоэнергетический фосфоэфир переходит в соединение, содержащее высокоэнергетический фосфат. Внутримолекулярные преобразования заключаются в переносе фосфатного остатка из положения 3 в фосфоглицерате в положение 2. Затем от образовавшегося 2-фосфоглицерата отщепляется молекула воды при участии фермента енолазы. В результате реакции образуется замещённый енол - фосфоенолпируват. Образованный фосфоенолпируват - макроэргическое соединение, фосфатная группа которого переносится в следующей реакции на АДФ при участии пируваткиназы. Превращение фосфоенолпирувата в пируват - необратимая реакция. Это вторая в ходе гликолиза реакция субстратного фосфорилирования. Образующаяся енольная форма пирувата затем неферментативно переходит в более термодинамически стабильную кетоформу.
NADH, образующийся при окислении глицеральдегид-3-фосфата в аэробном гликолизе, подвергается окислению путём переноса атомов водорода в митохондриальную дыхательную цепь. Так как сама молекула НАДН через мембрану не проходит, то существуют специальные системы, принимающие атомы водорода от НАДН в цитоплазме и отдающие их в матриксе митохондрий. Эти системы получили название челночные системы. Определены две основные челночные системы – глицеролфосфатная и малат-аспартатная. Ключевыми ферментами глицеролфосфатного челнока являются изоферменты глицерол-3-фосфат-дегидрогеназы – цитоплазматический и митохондриальный. Они отличаются своими коферментами: у цитоплазматической формы – НАД, у митохондриальной – ФАД. В цитозоле метаболиты гликолиза – диоксиацетонфосфат и НАДН образуют глицерол-3-фосфат, поступающий в матрикс митохондрий. Там он окисляется с образованием ФАДН2. Далее ФАДН2 направляется в дыхательную цепь и используется для получения энергии. Таким образом, в результате действий челнока цитозольный НАДН+H+ как бы "превращается" в митохондриальный ФАДН2. Этот челнок активен в печени и белых скелетных мышцах и необходим для получения энергии из глюкозы при работе клетки. Ключевыми ферментами малат-аспартатного челнока являются изоферменты малатдегидрогеназы – цитоплазматический и митохондриальный. Он является распространенным по всем тканям. Этот механизм более сложен: постоянно идущие в цитоплазме реакции трансаминирования аспарагиновой кислоты поставляют оксалоацетат, который под действием цитозольного пула малатдегидрогеназы и за счет "гликолитического" НАДН восстанавливается до яблочной кислоты (малата). Последняя антипортом с α-кетоглутаратом проникает в митохондрии и, являясь метаболитом ЦТК, окисляется в оксалоацетат с образованием НАДН. Так как мембрана митохондрий непроницаема для оксалоацетата, то он аминируется до аспарагиновой кислоты, которая в обмен на глутамат выходит в цитозоль. Таким образом, атомы водорода от цитозольного НАДН перемещаются в состав митохондриального НАДН.
Выход АТФ. Если в клетке имеется кислород, то НАДН из гликолиза направляется в митохондрию (челночные системы), на процессы окислительного фосфорилирования, и там его окисление приносит дивиденды в виде трех молекул АТФ. Обр-ся в гликолизе пируват в аэробных условиях превращается в ПВК-‑дегидрогеназном комплексе в ацетил-S-КоА, при этом образуется 1 молекула НАДН. Ацетил-S-КоА вовлекается в ЦТК и, окисляясь, дает 3 молекулы НАДН, 1 молекулу ФАДН2, 1 молекулу ГТФ. Молекулы НАДН и ФАДН2 движутся в дыхательную цепь (посмотреть), где при их окислении в сумме образуется 11 молекул АТФ. В целом при сгорании одной ацетогруппы в ЦТК образуется 12 молекул АТФ. Суммируя результаты окисления "гликолитического" и "пируватдегидрогеназного" НАДН, "гликолитический" АТФ, энергетический выход ЦТК и умножая все на 2, получаем 38 молекул АТФ. Суммарное уравнение: С6Н12О6 + 6О2 → 6СО2 + Н2О + 2880 кДж/моль.
Аэробный распад глюкозы происходит во многих органах и тканях и служит основным, хотя и не единственным, источником энергии для жизнедеятельности. Некоторые ткани находятся в наибольшей зависимости от катаболизма глюкозы как источника энергии. Например, клетки мозга расходуют до 100 г глюкозы в сутки, окисляя её аэробным путём. Поэтому недостаточное снабжение мозга глюкозой или гипоксия проявляются симптомами, свидетельствующими о нарушении функций мозга (головокружения, судороги, потеря сознания). Аэробный гликолиз способствует метаболизму клеток опухолей. При высоких нагрузках резко возрастает скорость анаэробного гликогенолиза, конечным продуктом которого является молочная кислота. Энергетически этот процесс примерно в 15 раз менее эффективен, чем аэробный окислительный распад гликогена до Н2О и СО2. Такой путь энергообеспечения мышц играет основную роль при кратковременной работе большей мощности, например при финишных рывках.
18. Биосинтез глюкозы (глюконеогенез): возможные предшественники, последовательность реакций. Глюкозо-лактатный цикл (цикл Кори) и глюкозо-аланиновый цикл: физиологическое значение. Значение и регуляция глюко-неогенеза из аминокислот.
В клетках организма всегда существует потребность в глюкозе:
1. для эритроцитов глюкоза является единственным источником энергии,
2.нервная ткань потребляет около 120 г глюкозы в сутки и эта величина практически не зависит от интенсивности ее работы. Только в экстремальных ситуациях (длительное голодание) она способна получать энергию из неуглеводных источников,
3. глюкоза играет весомую роль для поддержания необходимых концентраций метаболитов цикла трикарбоновых кислот (в первую очередь оксалоацетата).
Таким образом, при определенных ситуациях – при низком содержании углеводов в пище, голодании, длительной физической работе, т.е. когда глюкоза крови расходуется и наступает гипогликемия, организм должен иметь возможность синтезировать глюкозу и нормализовать ее концентрацию в крови. Это достигается реакциями глюконеогенеза. По определению, глюконеогенез – это синтез глюкозы из неуглеводных компонентов: лактата, пирувата, глицерола, кетокислот цикла Кребса и других кетокислот, из аминокислот. Необходимость глюконеогенеза в организме демонстрируют два цикла – глюкозо-лактатный и глюкозо-аланиновый.
Глюкозо-лактатный цикл (цикл Кори) – это циклический процесс, объединяющий реакции глюконеогенеза и реакции анаэробного гликолиза. Глюконеогенез происходит в печени, субстратом для синтеза глюкозы является лактат, поступающий в основном из эритроцитов или мышечной ткани. В эритроцитах молочная кислота образуется непрерывно, так как для них анаэробный гликолиз является единственным способом образования энергии. В скелетных мышцах высокое накопление молочной кислоты (лактата) является следствием гликолиза при очень интенсивной, субмаксимальной мощности, работе, при этом внутриклеточный рН снижается до 6,3-6,5. Но даже при работе низкой и средней интенсивности в скелетной мышце всегда образуется некоторое количество лактата. Убрать молочную кислоту можно только одним способом – превратить ее в пировиноградную кислоту. Однако сама мышечная клетка ни при работе, ни во время отдыха не способна превратить лактат в пируват из-за особенностей изофермента лактатдегидрогеназы-‑5. Зато клеточная мембрана высоко проницаема для лактата и он движется по градиенту концентрации наружу. Поэтому во время и после нагрузки (при восстановлении) лактат легко удаляется из мышцы. Это происходит довольно быстро, всего через 0,5-‑1,5 часа в мышце лактата уже нет. Малая часть молочной кислоты выводится с мочой. Большая часть лактата крови захватывается гепатоцитами, окисляется в пировиноградную кислоту и вступает на путь глюконеогенеза. Глюкоза, образованная в печени используется самим гепатоцитом или возвращается обратно в мышцы, восстанавливая во время отдыха запасы гликогена. Также она может распределиться по другим органам.
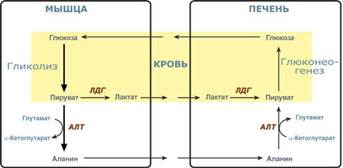 Глюкозо-аланиновый цикл. Целью глюкозо-аланинового цикла также является уборка пирувата, но, кроме этого решается еще одна немаловажная задача – уборка лишнего азота из мышцы.Аминокислоты, которые при катаболизме превращаются в пируват или метаболиты цитратного цикла, могут рассматриваться как потенциальные предшественники глюкозы и гликогена и носят название гликогенных. Например, оксалоацетат, образующийся из аспарагиновой кислоты, является промежуточным продуктом как цитратногр цикла, так и глюконеогенеза. Из всех аминокислот, поступающих в печень, примерно 30% приходится на долю аланина. Это объясняется тем, что при расщеплении мышечных белков образуются аминокислоты, многие из которых превращаются сразу в пируват или сначала в оксалоацетат, а затем в пируват. Последний превращается в аланин, приобретая аминогруппу от других аминокислот. Аланин из мышц переносится кровью в печень, где снова преобразуется в пируват, который частично окисляется и частично включается в глюкозонеогенез. При мышечной работе и в покое в миоците распадаются белки и образуемые аминокислоты трансаминируются с α-кетоглутаратом. Полученный глутамат взаимодействует с пируватом. Образующийся аланин является транспортной формой азота и пирувата из мышцы в печень. В гепатоците идет обратная реакция трансаминирования, аминогруппа передается на синтез мочевины, пируват используется для синтеза глюкозы.Кроме мышечной работы, глюкозо-аланиновый цикл активируется во время голодания, когда мышечные белки распадаются и многие аминокислоты используются в качестве источника энергии, а их азот необходимо доставить в печень.
Глюкозо-аланиновый цикл. Целью глюкозо-аланинового цикла также является уборка пирувата, но, кроме этого решается еще одна немаловажная задача – уборка лишнего азота из мышцы.Аминокислоты, которые при катаболизме превращаются в пируват или метаболиты цитратного цикла, могут рассматриваться как потенциальные предшественники глюкозы и гликогена и носят название гликогенных. Например, оксалоацетат, образующийся из аспарагиновой кислоты, является промежуточным продуктом как цитратногр цикла, так и глюконеогенеза. Из всех аминокислот, поступающих в печень, примерно 30% приходится на долю аланина. Это объясняется тем, что при расщеплении мышечных белков образуются аминокислоты, многие из которых превращаются сразу в пируват или сначала в оксалоацетат, а затем в пируват. Последний превращается в аланин, приобретая аминогруппу от других аминокислот. Аланин из мышц переносится кровью в печень, где снова преобразуется в пируват, который частично окисляется и частично включается в глюкозонеогенез. При мышечной работе и в покое в миоците распадаются белки и образуемые аминокислоты трансаминируются с α-кетоглутаратом. Полученный глутамат взаимодействует с пируватом. Образующийся аланин является транспортной формой азота и пирувата из мышцы в печень. В гепатоците идет обратная реакция трансаминирования, аминогруппа передается на синтез мочевины, пируват используется для синтеза глюкозы.Кроме мышечной работы, глюкозо-аланиновый цикл активируется во время голодания, когда мышечные белки распадаются и многие аминокислоты используются в качестве источника энергии, а их азот необходимо доставить в печень.
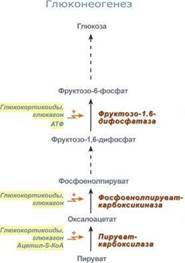
Глюконеогенез – это синтез глюкозы из неуглеводных компонентов: лактата, пирувата, глицерола, кетокислот цикла Кребса и других кетокислот, из АК. Все АК, кроме кетогенных лейцина и лизина, способны участвовать в синтезе глюкозы. Углеродные атомы некоторых из них – глюкогенных – полностью включаются в молекулу глюкозы, некоторых – смешанных – частично. Кроме получения глюкозы, глюконеогенез обеспечивает и уборку "шлаков" – лактата, постоянно образуемого в эритроцитах или при мышечной работе, и глицерола, являющегося продуктом липолиза в жировой ткани. Как известно, в гликолизе существуют три необратимые реакции: пируваткиназная (десятая), фосфофруктокиназная (третья) и гексокиназная (первая). В этих реакциях происходит высвобождение энергии для синтеза АТФ. Поэтому в обратном процессе возникают энергетические барьеры, которые клетка обходит с помощью дополнительных реакций. Глюконеогенез включает все обратимые реакции гликолиза, и особые обходные пути, т.е. он не полностью повторяет реакции окисления глюкозы. Его реакции способны идти во всех тканях, кроме последней глюкозо-6-фосфатазной реакции, которая идет только в печени и почках. Поэтому, строго говоря, глюконеогенез идет только в этих двух органах.
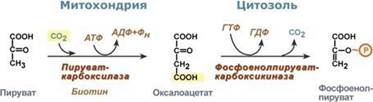 Обход десятой реакции гликолиза. На этом этапе глюконеогенеза работают два ключевых фермента – в митохондриях пируваткарбоксилаза и в цитозоле фосфоенолпируват-карбоксикиназа.В химическом плане обходной путь десятой реакции выглядит достаточно просто:
Обход десятой реакции гликолиза. На этом этапе глюконеогенеза работают два ключевых фермента – в митохондриях пируваткарбоксилаза и в цитозоле фосфоенолпируват-карбоксикиназа.В химическом плане обходной путь десятой реакции выглядит достаточно просто:
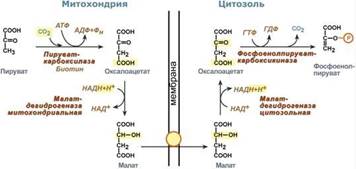 Однако дело в том, что пируваткарбоксилаза находится в митохондрии, а фосфоенолпируват-карбоксикиназа – в цитозоле. Дополняет проблему непроницаемость митохондриальной мембраны для оксалоацетата. Зато через мембрану может пройти малат, предшественник оксалоацетата по ЦТК. Поэтому в реальности все выглядит более сложно: 1. В цитозоле пировиноградная кислота может появиться при окислении молочной кислоты и в реакции трансаминирования аланина. После этого пируват симпортом с ионами Н+, движущимися по протонному градиенту, проникает в митохондрии. В митохондриях пируваткарбоксилаза превращает пировиноградную кислоту в оксалоацетат. Эта реакция идет в клетке постоянно, являясь анаплеротической (пополняюшей) реакцией ЦТК.
Однако дело в том, что пируваткарбоксилаза находится в митохондрии, а фосфоенолпируват-карбоксикиназа – в цитозоле. Дополняет проблему непроницаемость митохондриальной мембраны для оксалоацетата. Зато через мембрану может пройти малат, предшественник оксалоацетата по ЦТК. Поэтому в реальности все выглядит более сложно: 1. В цитозоле пировиноградная кислота может появиться при окислении молочной кислоты и в реакции трансаминирования аланина. После этого пируват симпортом с ионами Н+, движущимися по протонному градиенту, проникает в митохондрии. В митохондриях пируваткарбоксилаза превращает пировиноградную кислоту в оксалоацетат. Эта реакция идет в клетке постоянно, являясь анаплеротической (пополняюшей) реакцией ЦТК.
2. Далее оксалоацетат мог бы превратиться в фосфоенолпируват, но для этого сначала он должен попасть в цитозоль. Поэтому происходит реакция восстановления оксалоацетата в малат при участии малатдегидрогеназы.В результате малат накапливается, выходит в цитозоль и здесь превращается обратно в оксалоацетат. Повернуть малатдегидрогеназную реакцию ЦТК вспять позволяет избыток НАДН в митохондриях. НАДН поступает из?-‑окисления жирных кислот, активируемого в условиях недостаточности глюкозы в гепатоците.
3. В цитоплазме фосфоенолпируват-карбоксикиназа осуществляет превращение оксалоацетата в фосфоенолпируват, для реакции требуется энергия ГТФ. От молекулы отщепляется тот же углерод, что и присоединяется.
 Обход третьей реакции гликолиза. Второе препятствие на пути синтеза глюкозы – фосфофруктокиназная реакция – преодолевается с помощью фермента фруктозо-1,6-дифосфатазы. Этот фермент есть в почках, печени, поперечно-полосатых мышцах. Таким образом, эти ткани способны синтезировать фруктозо-6-фосфат и глюкозо-6-фосфат.
Обход третьей реакции гликолиза. Второе препятствие на пути синтеза глюкозы – фосфофруктокиназная реакция – преодолевается с помощью фермента фруктозо-1,6-дифосфатазы. Этот фермент есть в почках, печени, поперечно-полосатых мышцах. Таким образом, эти ткани способны синтезировать фруктозо-6-фосфат и глюкозо-6-фосфат.
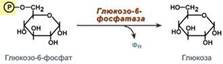 Обход первой реакции гликолиза. Последняя реакция катализируется глюкозо-6-фосфатазой. Она имеется только в печени и почках, следовательно, только эти ткани могут продуцировать свободную глюкозу.
Обход первой реакции гликолиза. Последняя реакция катализируется глюкозо-6-фосфатазой. Она имеется только в печени и почках, следовательно, только эти ткани могут продуцировать свободную глюкозу.
Глюконеогенез, как образование глюкозы из неуглеводных компонентов, необходим: 1. при гипогликемии во время мышечной нагрузки – синтез из молочной кислоты, поступающей из мышц, из глицерола, образующегося при мобилизации жиров;
2. при гипогликемии при голодании – синтез из аминокислот, образующихся при катаболизме белков.
 Таким образом, при голодании или физической нагрузке глюконеогенез, идущий в печени, обеспечивает глюкозой все остальные органы (эритроциты, нервная ткань, мышцы и др.), в которых активен гликолиз и другие процессы, производящие энергию. Наличие глюкозы в указанных клетках необходимо, чтобы поддержать концентрацию оксалоацетата и обеспечить сгорание ацетил-SКоА (получаемого также из жирных кислот или кетоновых тел) в цикле трикарбоновых кислот.
Таким образом, при голодании или физической нагрузке глюконеогенез, идущий в печени, обеспечивает глюкозой все остальные органы (эритроциты, нервная ткань, мышцы и др.), в которых активен гликолиз и другие процессы, производящие энергию. Наличие глюкозы в указанных клетках необходимо, чтобы поддержать концентрацию оксалоацетата и обеспечить сгорание ацетил-SКоА (получаемого также из жирных кислот или кетоновых тел) в цикле трикарбоновых кислот.
Регуляция глюконеогенеза. Гормональная активация глюконеогенеза осуществляется глюкокортикоидами, которые увеличивают синтез пируваткарбоксилазы, фосфоенолпируват-карбоксикиназы, фруктозо-1,6-дифосфатазы. Глюкагон стимулирует те же самые ферменты через аденилатциклазный механизм путем фосфорилирования.Также имеется метаболическая регуляция, при которой аллостерически активируется пируваткарбоксилаза при помощи ацетил-SКоА, фруктозо-1,6-дифосфатаз а при участии АТФ. Переключение печени с гликолиза на глюконеогенез и обратно происходит с участием инсулина и глюкозагона и осуществляется с помощью:
- аллостерической регуляции активности ферментов;
-ковалентной модификации ферментов путём фосфорилирования/дефосфорилирования;
-индукции/репрессии синтеза ключевых ферментов.
Регуляторные воздействия направлены на ферменты, катализирующие необратимые стадии глюконеогенеза, сочетание которых называют "субстратными", или "холостыми" циклами.
Суммарное уравнение глюконеогенеза из пирувата:
2 пируват + 4 ATФ + 2 GTP + 2(NADH) + 4 Н2О Глюкоза + 4 ADP + 2 GDP + 2 NAD+ + 6 Н3РО4.
За сутки в организме человека может синтезироваться до 80 г глюкозы. На синтез 1 моль глюкозы из пирувата расходуется 6 макроэргических связей (4 ATФ и 2 GTP).
19. Пентозофосфатный путь превращения глюкозы. Окислительный путь образования пентоз. Представление о неокислительном пути образования гексоз. Распространение, роль, регуляция.
Глюкоза – это субстрат для получения энергии. Энергетика любой клетки нашего организма основана на окислении глюкозы. Окисление глюкозы происходит по двум направлениям:
1.Окисление с образованием пентоз: рибозы, рибулозы, ксилулозы. Этот путь называется пентозофосфатный шунт и не связан с получением Е.
2. Окисление с получением Е.
Так как в кл непрерывно просходят реакции синтеза белков, то для этого процесса требуются рибонуклеиновые кислоты. В свою очередь для синтеза самих нуклеиновых кислот, а точнее пуриновых и пиримидиновых нуклеотидов, требуется рибозо-5-фосфат. Если клетка готовится к делению, то для синтеза ДНК ей нужны дезоксирибонуклеотиды, которые образуются при участии НАДФН. Молекулы НАДФН также используются:
-для синтеза жирных к-т (печень, жировая ткань),
-для синтеза холестерола и др стероидов (печень),
-для синтеза глутаминовой к-ты из α-кетоглутаровой к-ты (реакция восстановительного аминирования),
-для систем антиоксидантной защиты клетки от свободно-радикального окисления (эритроциты).
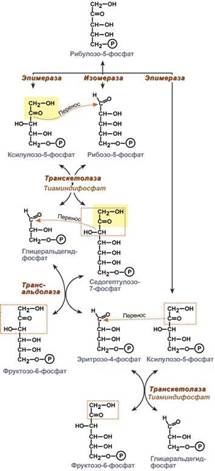
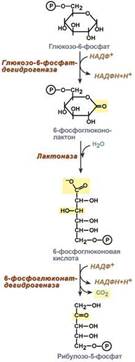 В клетке существует процесс, обеспечивающий одновременное образование рибозы и НАДФН – это пентозофосфатный путь. Наиболее активно реакции пентозофосфатного пути идут в цитозоле клеток печени, жировой ткани, эритроцитах, коре надпочечников, молочной железе при лактации, в гораздо меньшей степени в скелетных мышцах. Этот путь окисления глюкозы не связан с образованием энергии, а обеспечивает анаболизм клеток. В связи с этим у новорожденных и детей первых лет жизни его активность довольно высока. Пентозофосфатный путь включает два этапа – окислительный и структурных перестроек (неокислительный).
В клетке существует процесс, обеспечивающий одновременное образование рибозы и НАДФН – это пентозофосфатный путь. Наиболее активно реакции пентозофосфатного пути идут в цитозоле клеток печени, жировой ткани, эритроцитах, коре надпочечников, молочной железе при лактации, в гораздо меньшей степени в скелетных мышцах. Этот путь окисления глюкозы не связан с образованием энергии, а обеспечивает анаболизм клеток. В связи с этим у новорожденных и детей первых лет жизни его активность довольно высока. Пентозофосфатный путь включает два этапа – окислительный и структурных перестроек (неокислительный).
На первом, окислительном, этапе глюкозо-6-фосфат в трех реакциях превращается в рибулозо-5-фосфат, реакции сопровождаются восстановлением двух молекул НАДФ до НАДФН.
 На этом этапе происходит регуляция процесса: инсулин повышает активность глюкозо-6-фосфат-дегидрогеназы и фосфоглюконат-дегидрогеназы.
На этом этапе происходит регуляция процесса: инсулин повышает активность глюкозо-6-фосфат-дегидрогеназы и фосфоглюконат-дегидрогеназы.
В окислительной части пентозофосфатного пути глюкозо-6-фосфат подвергается окислительному декарбоксилированию, в результате которого образуются пентозы. Этот этап включает 2 реакции дегидрирования. Суммарное уравнение: Глюкозо-6-фосфат + 2 NADP+ + Н2О → Рибулозо-5-фосфат + 2 NADPH + Н+ + СО2.
Реакции окислительного пути протекают только в том случае, если восстановленный ко-фермент NADPH возвращается в исходное окисленное состояние NADP+ при участии NADPH-зависимых дегидрогеназ. Если потребности клетки в NADPH незначительны, рибо-зо-5-фосфат образуется в результате обратимых реакций неокислительного этапа пентозофосфатного пути, используя в качестве исходных в-в метаболиты гликолиза - глицеральдегид-3-фосфат и фруктозо-6-фосфат.
Роль: Реакции окислительного этапа служат основным источником NADPH в клетках. Гидрированные коферменты снабжают водородом биосинтетические процессы, окислительно-восстановительные реакции, включающие защиту клеток от активных форм О2.
Второй этап – этап структурных перестроек, благодаря которым пентозы способны возвращаться в фонд гексоз. В этих реакциях рибулозо-5-фосфат изомеризуется до рибозо-5-фосфата и ксилулозо-5-фосфата. Далее под влиянием ферментов транскетолазы и трансальдолазы происходят структурные перестройки с образованием других моносахаридов. При реализации всех реакций второго этапа пентозы превращаются во фруктозо-6-фосфат и глицеральдегидфосфат. Глицеральдегид-3-фосфат в зависимости от условий и вида клеток может либо "проваливаться" во 2-й этап гликолиза либо через диоксиацетонфосфат восстанавливаться до глицерол-3-фосфата и далее направляться в синтез фосфатидной кислоты и далее триацилглицеролов. При необходимости из него могут образоваться и гексозы.
Сумма: 2 Фруктозо-6-фосфат + Глицеральдегид-3-фосфат → 2 Ксилулозо-5-фосфат + Рибозо-5-фосфат 2 Ксилулозо-5-фосфат → 2 Рибулозо-5-фосфат 2 Рибулозо-5-фосфат → 2 Рибозо-5-фосфат.
Т.о. неокислительный путь можно представить как процесс возвращения пентоз в фонд гексоз.
Особенности пентозофосфатного пути в разных клетках.
Если клетка нуждается в больших количествах НАДФН (например, синтез жирных кислот в печени или синтез холестерола), то активно будут идти как 1-й, так и 2-й этапы. Образованные фруктозо-6-фосфат и глицеральдегидфосфат в реакциях глюконеогенеза превратятся в глюкозо-6-фосфат, и цикл начнется вновь.
Если клетке нужны НАДФН и энергия АТФ (как в эритроците), то фруктозо-6-фосфат и глицеральдегидфосфат на выходе из 2-го этапа "провалятся" в гликолитические реакции.
Если клетка растет и делится, то ей необходимы НАДФН и рибозо-5-фосфат. В этом случае 2-й этап идти не будет, весь образуемый на 1-м этапе рибулозо-5-фосфат превратится в рибозо-5-фосфат, который используется для синтеза нуклеотидов. НАДФН будет расходоваться на синтез дезоксирибонуклеотидов.
Пентозофосфатный путь обеспечивает клетки рибозой для синтеза пуриновых и пиримидиновых нуклеотидов и гидрированным ко-ферментом NADPH, который используется в восстановительных процессах. Суммарное уравнение пентозофосфатного пути выражается следующим образом:
3 Глюкозо-6-фосфат + 6 NADP+ → 3 СО2 + 6 (NADPH + Н+) + 2 Фруктозо-6-фосфат + Глицеральдегид-3-фосфат.
Ферменты пентозофосфатного пути, так же, как и ферменты гликолиза, локализованы в цитозоле.
Наиболее активно Пентозофосфатный путь протекает в жировой ткани, печени, коре надпочечников, эритроцитах, молочной железе в период лактации, семенниках.
Из нарушений пентозофосфатного шунта наиболее часто встречается недостаточность первого фермента – глюкозо-6-фосфат-дегидрогеназы. Следствием ферментного дефекта является снижение синтеза НАДФН в клетке. Особенно существенно это влияет на эритроциты, в которых окислительный этап пентозофосфатного цикла является единственным источником НАДФН. з разнообразных функций НАДФН в данном случае имеет значение одна – участие в работе антиоксидантной системы.
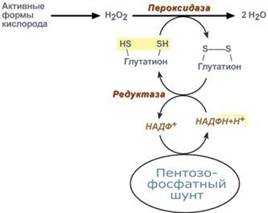 Данная система необходима для нейтрализации активных форм кислорода, постоянно образующихся в клетке. В частности, перекись водорода восстанавливается до воды с помощью глутатион-зависимой пероксидазы. Восстановление глутатиона в работоспособное состояние производит редуктаза при участии НАДФН, поставляемого пентозофосфатным шунтом.
Данная система необходима для нейтрализации активных форм кислорода, постоянно образующихся в клетке. В частности, перекись водорода восстанавливается до воды с помощью глутатион-зависимой пероксидазы. Восстановление глутатиона в работоспособное состояние производит редуктаза при участии НАДФН, поставляемого пентозофосфатным шунтом.
20. Глюкоза крови: источники, регуляция гормонами. Гипо- и гипергликемия, причины. Сахарные нагрузки и сахарные кривые, значение в диагностике.
Результат регуляции метаболических путей превращения глюкозы - постоянство концентрации глюкозы в крови. У здорового человека на тощак концентрация глюкозы в артериальной крови в течение суток поддерживается на постоянном уровне 60-100 мг/дл (3,3-5,5 ммоль/л). После приёма углеводной пищи уровень глюкозы возрастает в течение примерно 1 ч до 150 мг/дл (алиментарная гипергликемия), а затем возвращается к нормальному уровню (примерно через 2 ч). При конц-ии глюкозы в крови 9-10 ммоль/л глюкоза начинает выводиться с мочой – глюкозурия. В норме глюкоза в моче не определяется. Более половины всей глюкозы (60%), поступающей из кишечника в воротную вену, поглощается печенью. Около 2/3 этого количества откладывается в печени в форме гликогена, остальная часть превращается в жиры и окисляется, обеспечивая синтез АТФ. Ускорение этих процессов инициируется повышением инсулинглюкагонового индекса. Другая часть глюкозы, поступающей из кишечника, попадает в общий кровоток. Примерно 2/3 этого количества поглощается мышцами и жировой тканью. Это обусловлено увеличением проницаемости мембран мышечных и жировых клеток для глюкозы под влиянием высокой концентрации инсулина. Глюкоза в мышцах откладывается в форме гликогена, а в жировых клетках превращается в жиры. Остальная часть глюкозы общего кровотока поглощается другими клетками (инсулинонезависимыми).
При голодании в течение первых суток исчерпываются запасы гликогена в организме, и в дальнейшем источником глюкозы служит только глюконеогенез (из лактата, глицерина и АК). Глюконеогенез при этом ускоряется, а гликолиз замедляется вследствие низкой концентрации инсулина и высокой концентрации глюкагона. Но, кроме того, через 1-2 сут существенно проявляется действие и другого механизма регуляции - индукции и репрессии синтеза некоторых ферментов: снижается кол-во гликолитических ферментов и, наоборот, повышается количество ферментов глюконеогенеза. Изменение синтеза ферментов также связано с влиянием инсулина и глюкагона. Начиная со второго дня голодания достигается максимальная скорость глюконеогенеза из аминокислот и глицерина. Скорость глюконеогенеза из лактата остаётся постоянной. В результате синтезируется около 100 г глюкозы ежесуточно, главным образом в печени. Следует отметить, что при голодании глюкоза не используется мышечными и жировыми клетками, поскольку в отсутствие инсулина не проникает в них и таким образом сберегается для снабжения мозга и других глюкозозависимых клеток. Как в период покоя, так и во время продолжительной физической работы сначала источником глюкозы для мышц служит гликоген, запасённый в самих мышцах, а затем глюкоза крови. Известно, что 100 г гликогена расходуется на бег примерно в течение 15 мин, а запасы гликогена в мышцах после приёма углеводной пищи могут составлять 200-300 г.
Регуляция: Нервная регуляция концентрации глюкозы в крови выражается в положительном влиянии n.vagus на секрецию инсулина и тормозящем влиянии на этот процесс симпатической иннервации. Кроме этого, выделение адреналина в кровь подвержено симпатическим влияниям.
Основными факторами гормональной регуляции являются глюкагон, адреналин, глюкокортикоиды, соматотропный гормон с одной стороны, и инсулин с другой. Все гормоны, кроме инсулина, влияя на печень, увеличивают гликемию. Инсулин является единственным гормоном ор-ма, действие которого нацелено на снижение уровня глюкозы крови. При его влиянии глюкозу усиленно поглощают мышцы и жировая ткань. Уменьшение конц-ии глюкозы в крови инсулином достигается следующими путями:
-переход глюкозы в клетки – активация белков-транспортеров ГлюТ 4 на цитоплазматической мембране,
-вовлечение глюкозы в гликолиз – повышение синтеза глюкокиназы – фермента, получившего название "ловушка для глюкозы", стимуляция синтеза других ключевых ферментов гликолиза – фосфофруктокиназы, пируваткиназы,
-увеличение синтеза гликогена – активация гликогенсинтазы и стимуляция ее синтеза, что облегчает превращение излишков глюкозы в гликоген,
-активация пентозофосфатного пути – индукция синтеза глюкозо-6-фосфат-дегидрогеназы и 6-фосфоглюконатдегидрогеназы,
-усиление липогенеза – вовлечение глюкозы в синтез триацилглицеролов или фосфолипидов.
Многие ткани совершенно нечувствительны к действию инсулина, их называют инсулиннезависимыми. К ним относятся нервная ткань, стекловидное тело, хрусталик, сетчатка, клубочковые клетки почек, эндотелиоциты, семенники и эритроциты. Глюкагон повышает содержание глюкозы крови:
-увеличивая мобилизацию гликогена через активацию гликогенфосфорилазы,
-стимулируя глюконеогенез – повышение работы ферментов пируваткарбоксилазы, фосфоенолпируват-карбоксикиназы, фруктозо-1,6-дифосфатазы.
Адреналин вызывает гипергликемию:
-активируя мобилизацию гликогена – стимуляция гликогенфосфорилазы,
Глюкокортикоиды повышают глюкозу крови
-за счет подавления перехода глюкозы в клетку,
-стимулируя глюконеогенез – увеличивают синтез ферментов пируваткарбоксилазы, фосфоенолпируват-карбоксикиназы, фруктозо-1,6-дифосфатазы.
Основные аспекты гормональных влияний:
Снижение глюкозы крови Повышение глюкозы крови
Инсулин Адреналин
Повышение ГлюТ 4-зависимого тр-та глюкозы в кл Активация гликогенолиза в печени
Усиление синтеза гликогена Глюкагон
Активация ПФП Активация гликогенолиза в печени
Активация гликолиза и ЦТК Стимуляция глюконеогенеза
Глюкокортикоиды
Усиление глюконеогенеза
Уменьшение проницаемости мембран для глюкозы
Гипергликемические состояния. Не представляют острой угрозы для жизни, но если уровень глюкозы от 16 до 22 ммоль/л сохраняется несколько дней, то глюкозы уходит из организма с мочой это влечет одновременную потерю воды и электроллитовприводит к прогрессирующей дегидратации и уменешению объёма крови, понижению кровяного давления, шоку, коме. Длительная гипергликемия – главная причина осложнений при сахарном диабете. Высокий уровень глюкозы вызывает неферментативное гликозилирование белков. В норме их 6%, при паталогии в 2-3 раза больше. Гликозилированные белки изменяют свою конформацию, поверхностный заряд, в следствии этого изменяются свойства белков и их взаимодействие с лигандами (гликозилированный гемоглобин имеет высокое сродство к О2, в рез-те О2 не поступает в кл, разв-ся гипоксия).Гипергликемическим является состояние, при котором концентрация глюкозы в крови более 6 ммоль/л. По происхождению выделяют две группы таких состояний:
Физиологически е 1)алиментарные – связаны с приемом пищи и продолжаются в норме не более 2 часов после еды. 2) нейрогенные – нервное напряжение, стимулирующее секрецию адреналина и мобилизацию гликогена в печени, 3) гипергликемия беременных – связана с относительной недостаточностью инсулина при увеличении массы тела и потребностью плода в глюкозе.
Патологические 1) при заболеваниях гипофиза, коры и мозгового слоя надпочечников, щитовидной железы, связанных с избытком гликемических гормонов, 2) при органических поражениях ЦНС,
поражении β-клеток поджелудочной железы.
Гипогликемические состояния. Гипогликемия опасна для жизни. Если глюкоза снижаетсяот 2,2 до 2,7 ммоль/л и остается таковой в течении 10 минут, это может привести к необратимому повреждению кл мозга., т.к. в кач-ве источника Е мозг исп-ет исключительно глюкозу (в обычных условиях) Гипогликемическим является состояние, при котором концентрация глюкозы в крови ниже 3,5 ммоль/л. Причиной гипогликемий может явиться:
Физиологические краткое или долгосрочное голодание, малоуглеводная диета.
Патологические 1) гиперинсулинизм в результате передозировки или инсулиномы (инсулинпродуцирующая опухоль) или избыточной активности инсулиназы (синдром Мак-Куорри),
2) гликогенозы, 3) недостаток гликемических гормонов при гипопитуитаризме, аддисоновой болезни,
4)у недоношенных и новорожденных – охлаждение, малые запасы гликогена в печени и ее общая незрелость, 5) нарушения кишечника, гельминтозы, дисбактериозы.
Сахарные нагрузки и сахарные кривые используют для диагностики сахарного диабета. Обследуемому даётся р-р глюкозы из расчета 1гм на 1кг массы тела. Концентрацию глюкозы измеряют сначала на тощак, а потом в течении 2-3х часов с интервалом в 1ч. По результатам строятся сахарные кривые.
21. Функции липидов. Пищевые жиры; норма суточного потребления, переваривание, всасывание продуктов переваривания. Ресинтез жиров в клетках кишечника. Хиломикроны, строение, значение, метаболизм. Пределы изменения концентрации жиров в крови.
Липиды – органические вещества, характерные для живых организмов, нерастворимые в воде, но растворимые в органических растворителях и друг в друге.
Классификация липидов организма человека
1. Гликолипиды. Содержат углеводный компонент.
2. Жиры. Эфиры глицерина и высших жирных кислот. Химическое название - ацилглицерины. Преобладают триацилглицерины.
3. Минорные липиды. Свободные жирные кислоты, жирорастворимые витамины, биологически активные вещества липидной природы - простагландины и др.
4. Стероиды. В основе строения - полициклическая структура циклопентанпергидрофенантрен-стеран.
А. Стерины (спирты). Наиболее важен холестерин.
В. Стериды. Эфиры стеринов и высших жирных кислот. Наиболее распространены эфиры холестерина.
5. Фосфолипипы. Отличительная особенность - остаток фосфорной кислоты в составе молекулы.
Группы липидов отличаются по степени гидрофобности. Фосфолипиды и гликолипиды являются полярными липидами.
Холестерин занимает промежуточное положение между полярными и абсолютно гидрофобными липидами.
Абсолютно гидрофобными являются триглицериды и эфиры холестерина.
Большинство липидов (кроме стеринов и некоторых минорных липидов) содержат высшие жирные кислоты (ВЖК). В состав мембран входят только фосфолипиды (ФЛ), гликолипиды (ГЛ) и холестерин (ХС).
Функции:
1. Резервно-энергетическая функция. Триацилглицеролы подкожного жира являются основным энергетическим резервом организма при голодании. В адипоцитах жиры могут составлять 65-85% веса. Для поперечно-полосатой мускулатуры, печени и почек они являются основным источником энергии. При расщеплении 1г жира обр-ся 9,3 кКал Е. Является резервом эндогенной воды (окисление 1г жира даёт 1,7г воды)
2. Структурная функция. Мембраны клеток состоят из фосфолипидов, обязательным компонентом являются гликолипиды и холестерол. Основным компонентом сурфактанта легких является фосфатидилхолин. Т.к. активность мембранных ферментов зависит от состояния и текучести мембран, то жирнокислотный состав и наличие определенных видов фосфолипидов, количество холестерола влияет на активность мембранных липидзависимых ферментов (например, аденилатциклаза, Nа+,К+-АТФаза, цитохромоксидаза). Обеспечивают изберательную проницаемость, входят в состав рецепторов, определяют активный транспорт, образуют биопотенциалы.
3. Сигнальная функция. Гликолипиды выполняют рецепторные функции и задачи взаимодействия с другими клетками. Фосфатидилинозитол непосредственно принимает участие в передаче гормональных сигналов в клетку. Производные жирных кислот – эйкозаноиды – являются "местными или тканевыми гормонами", обеспечивая регуляцию функций клеток.
4. Защитная функция. Подкожный жир является хорошим термоизолирующим средством, наряду с брыжеечным жиром он обеспечивает механическую защиту внутренних органов. Фосфолипиды играют определенную роль в активации свертывающей системы крови. Сохранение тепла происходит благодаря низкой теплопроводности.
5. Необходимы для растворения и всасывая жирорастворимых витаминов (А, Е, D, K, Q)
6. Являются предшественниками других соединений: глицерин испол-ся на синтез глюкозы, жирные к-ты окисляются до ацетилКоА и могут быть использованы на образование ацетилхолина)
7. Специфические функции: обеспечивают устойчивость эритроцитов, ганглиозиды связывают различные токсины и яды.
С пищей в организм ежедневно поступает от 80 до 150 г липидов. Основную массу составляют жиры, наряду с глюкозой служащие главными источниками энергии. Хотя калорийность жиров значительно выше, чем углеводов (9 по сравнению с 4,7 ккал/моль), при рациональном питании жиры обеспечивают не более 30% от общего количества калорий, поступающих с пищей. Жидкие жиры (масла) содержат в своём составе полиеновые жирные кислоты, которые не синтезируются в организме; поэтому жидкие жиры должны составлять не менее одной трети жиров пищи. Потребность в липидах взрослого организма составляет 80-100 г в сутки, из них растительных (жидких) жиров должно быть не менее 30%. С пищей в основном поступают триацилглицеролы, фосфолипиды и эфиры ХС.
Переваривание липидов осложняется тем, что их молекулы полностью или частично гидрофобны. Для преодоления этой помехи используется процесс эмульгирования, когда гидрофобные молекулы (ТАГ, эфиры ХС) или гидрофобные части молекул (ФЛ, ХС) погружаются внутрь мицеллы, а гидрофильные остаются на поверхности, обращенной к водной фазе. Условно внешний обмен липидов можно подразделить на следующие этапы:
1. Эмульгирование жиров пищи – необходимо для того, чтобы ферменты ЖКТ смогли начать работу.
2. Гидролиз триацилглицеролов, фосфолипидов и эфиров ХС под влиянием ферментов ЖКТ.
3. Образование мицелл из продуктов переваривания (жирных кислот, МАГ, холестерола).
4. Всасывание образованных мицелл в эпителий кишечника.
5. Ресинтез триацилглицеролов, фосфолипидов и эфиров ХС в энтероцитах.
После ресинтеза липидов в кишечнике они собираются в транспортные формы – хиломикроны (основные) и липопротеины высокой плотности (ЛПВП) (малое кол-во) – и разносятся по организму.
Первые два этапа переваривания липидов, эмульгирование и гидролиз, происходят практически одновременно. Вместе с этим, продукты гидролиза не удаляются, а оставаясь в составе липидных капелек, облегчают дальнейшее эмульгирование и работу ферментов.
Переваривание в ротовой полости. У взрослых в ротовой полости переваривание липидов не идет, хотя длительное пережевывание пищи способствует частичному эмульгированию жиров.
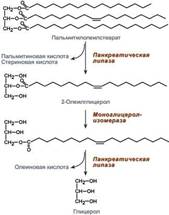 Переваривание в желудке. Собственная липаза желудка у взрослого не играет существенной роли в переваривании липидов из-за ее небольшого количества и того, что ее оптимум рН 4,5-5,5. Также влияет отсутствие эмульгированных жиров в обычной пище (кроме молока). Тем не менее, у взрослых теплая среда и перистальтика желудка вызывает некоторое эмульгирование жиров. При этом даже низко активная липаза расщепляет незначительные количества жира, что важно для дальнейшего переваривания жиров в кишечнике, т.к. наличие хотя бы минимального количества свободных жирных кислот облегчает эмульгирование жиров в двенадцатиперстной кишке и стимулирует секрецию панкреатической липазы.
Переваривание в желудке. Собственная липаза желудка у взрослого не играет существенной роли в переваривании липидов из-за ее небольшого количества и того, что ее оптимум рН 4,5-5,5. Также влияет отсутствие эмульгированных жиров в обычной пище (кроме молока). Тем не менее, у взрослых теплая среда и перистальтика желудка вызывает некоторое эмульгирование жиров. При этом даже низко активная липаза расщепляет незначительные количества жира, что важно для дальнейшего переваривания жиров в кишечнике, т.к. наличие хотя бы минимального количества свободных жирных кислот облегчает эмульгирование жиров в двенадцатиперстной кишке и стимулирует секрецию панкреатической липазы.
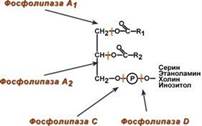 Переваривание в кишечнике. Под влиянием перистальтики ЖКТ и составных компонентов желчи пищевой жир эмульгируется. Образующиеся лизофосфолипиды также являются хорошим поверхностно- активным веществом, поэтому они способствуют эмульгированию пищевых жиров и образованию мицелл. Размер капель такой жировой эмульсии не превышает 0,5 мкм. Гидролиз эфиров ХС осуществляет холестерол-эстераза панкреатического сока. Переваривание ТАГ в кишечнике осуществляется под воздействием панкреатической липазы с оптимумом рН 8,0-9,0. В кишечник она поступает в виде пролипазы, активируемой при участии колипазы. Колипаза, в свою очередь, активируется трипсином и затем образует с липазой комплекс в соотношении 1:1. Панкреатическая липаза отщепляет жирные кислоты, связанные с С1 и С3 атомами углерода глицерола. В результате ее работы остается 2-моноацилглицерол (2-МАГ). 2-МАГ всасываются или превращаются моноглицерол-изомеразой в 1-МАГ. Последний гидролизуется до глицерола и жирной кислоты. Примерно 3/4 ТАГ после гидролиза остаются в форме 2-МАГ и только 1/4 часть ТАГ гидролизуется полностью. В панкреатическом соке также имеется активируемая трипсином фосфолипаза А2, отщепляющая жирную кислоту от С2. Обнаружена активность фосфолипазы С и лизофосфолипазы. В кишечном соке имеется активность фосфолипазы А2 и С. Имеются также данные о наличии в других клетках организма фосфолипаз А1 и D.
Переваривание в кишечнике. Под влиянием перистальтики ЖКТ и составных компонентов желчи пищевой жир эмульгируется. Образующиеся лизофосфолипиды также являются хорошим поверхностно- активным веществом, поэтому они способствуют эмульгированию пищевых жиров и образованию мицелл. Размер капель такой жировой эмульсии не превышает 0,5 мкм. Гидролиз эфиров ХС осуществляет холестерол-эстераза панкреатического сока. Переваривание ТАГ в кишечнике осуществляется под воздействием панкреатической липазы с оптимумом рН 8,0-9,0. В кишечник она поступает в виде пролипазы, активируемой при участии колипазы. Колипаза, в свою очередь, активируется трипсином и затем образует с липазой комплекс в соотношении 1:1. Панкреатическая липаза отщепляет жирные кислоты, связанные с С1 и С3 атомами углерода глицерола. В результате ее работы остается 2-моноацилглицерол (2-МАГ). 2-МАГ всасываются или превращаются моноглицерол-изомеразой в 1-МАГ. Последний гидролизуется до глицерола и жирной кислоты. Примерно 3/4 ТАГ после гидролиза остаются в форме 2-МАГ и только 1/4 часть ТАГ гидролизуется полностью. В панкреатическом соке также имеется активируемая трипсином фосфолипаза А2, отщепляющая жирную кислоту от С2. Обнаружена активность фосфолипазы С и лизофосфолипазы. В кишечном соке имеется активность фосфолипазы А2 и С. Имеются также данные о наличии в других клетках организма фосфолипаз А1 и D.
Образование мицелл. В результате воздействия на эмульгированные жиры ферментов панкреатического и кишечного соков образуются 2-моноацилглицеролы, жирные кислоты и свободный холестерол, формирующие структуры мицеллярного типа (размер около 5 нм). Свободный глицерол всасывается прямо в кровь.
 После расщепления полимерных липидных молекул полученные мономеры всасываются в верхнем отделе тонкого кишечника в начальные 100 см. В норме всасывается 98% пищевых липидов.
После расщепления полимерных липидных молекул полученные мономеры всасываются в верхнем отделе тонкого кишечника в начальные 100 см. В норме всасывается 98% пищевых липидов.
1. Короткие жирные кислоты (не более 10 атомов углерода) всасываются и переходят в кровь без каких-либо особенных механизмов. Этот процесс важен для грудных детей, т.к. молоко содержит в основном коротко- и среднецепочечные жирные кислоты. Глицерол тоже всасывается напрямую.
2. Другие продукты переваривания (жирные кислоты, холестерол, моноацилглицеролы) образуют с желчными кислотами мицеллы с гидрофильной поверхностью и гидрофобным ядром. Их размеры в 100 раз меньше самых мелких эмульгированных жировых капелек. Через водную фазу мицеллы мигрируют к щеточной каемке слизистой оболочки. Здесь мицеллы распадаются и липидные компоненты проникают внутрь клетки, после чего транспортируются в эндоплазматический ретикулум. Желчные кислоты частично также могут попадать в клетки и далее в кровь воротной вены, однако большая их часть остается в химусе и достигает подвздошной кишки, где всасывается при помощи активного транспорта.
 Ресинтез липидов в энтероцитах. После всасывания продуктов гидролиза жиров жирные кислоты и 2-моноацилглицеролы в клетках слизистой оболочки тонкого кишечника включаются в процесс ресинтеза с образованием триацилглицеролов. Жирные кислоты вступают в реакцию этерификации только в активной форме в виде производных коэнзима А, поэтому первая стадия ресинтеза жиров - реакция активации жирной кислоты:
Ресинтез липидов в энтероцитах. После всасывания продуктов гидролиза жиров жирные кислоты и 2-моноацилглицеролы в клетках слизистой оболочки тонкого кишечника включаются в процесс ресинтеза с образованием триацилглицеролов. Жирные кислоты вступают в реакцию этерификации только в активной форме в виде производных коэнзима А, поэтому первая стадия ресинтеза жиров - реакция активации жирной кислоты:
HS КоА + RCOOH + АТФ → R-CO ~ КоА + АМФ + Н4Р2О7.
Реакция катализируется ферментом ацил-КоА-синтетазой (тиокиназой). Затем ацил~КоА участвует в реакции этерификации 2-моноацилглицерола с образованием сначала диацилгли-церола, а затем триацилглицерола. Реакции ресинтеза жиров катализируют ацилтранеферазы.Ресинтез липидов – это синтез липидов в стенке кишечника из поступающих сюда экзогенных жиров, иногда могут использоваться и эндогенные жирные кислоты. Основная задача этого процесса – связать поступившие с пищей средне- и длинноцепочечные жирные кислоты со спиртом – глицеролом или холестеролом. Это ликвидирует их детергентное действие на мембраны и позволит переносить по крови в ткани. Поступившая в энтероцит жирная кислота обязательно активируется через присоединение коэнзима А. Образовавшийся ацил-SКоА участвует в реакциях синтеза эфиров холестерола, триацилглицеролов и фосфолипидов.
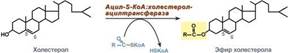 Ресинтез эфиров холестерола. Холестерол этерифицируется с использованием ацил-S-КоА и фермента ацил-КоА:холестерол-ацилтрансферазы (АХАТ). Реэтерификация холестерола напрямую влияет на его всасывание в кровь. В настоящее время ищутся возможности подавления этой реакции для снижения концентрации ХС в крови.
Ресинтез эфиров холестерола. Холестерол этерифицируется с использованием ацил-S-КоА и фермента ацил-КоА:холестерол-ацилтрансферазы (АХАТ). Реэтерификация холестерола напрямую влияет на его всасывание в кровь. В настоящее время ищутся возможности подавления этой реакции для снижения концентрации ХС в крови.
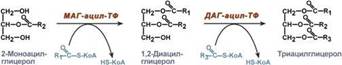 Ресинтез триацилглицеролов. Для ресинтеза ТАГ есть два пути: Первый путь, основной – 2-моноацилглицеридный – происходит при участии экзогенных 2-МАГ и ЖК в гладком эндоплазматическом ретикулуме энтероцитов: мультиферментный комплекс триацилглицерол-синтазы формирует ТАГ. Поскольку 1/4 часть ТАГ в кишечнике полностью гидролизуется и глицерол в энтероцитах не задерживается, то возникает относительный избыток жирных кислот для которых не хватает глицерола. Поэтому существует второй, глицеролфосфатный, путь в шероховатом эндоплазматическом ретикулуме. Источником глицерол-3-фосфата служит окисление глюкозы, так как пищевой глицерол быстро покидает энтероциты и уходит в кровь. Здесь можно выделить следующие реакции: 1. Образование глицерол-3-фосфата из глюкозы. 2.Превращение глицерол-3-фосфата в фосфатидную кислоту. 3.Превращение фосфатидной кислоты в 1,2-ДАГ. 3.Синтез ТАГ.
Ресинтез триацилглицеролов. Для ресинтеза ТАГ есть два пути: Первый путь, основной – 2-моноацилглицеридный – происходит при участии экзогенных 2-МАГ и ЖК в гладком эндоплазматическом ретикулуме энтероцитов: мультиферментный комплекс триацилглицерол-синтазы формирует ТАГ. Поскольку 1/4 часть ТАГ в кишечнике полностью гидролизуется и глицерол в энтероцитах не задерживается, то возникает относительный избыток жирных кислот для которых не хватает глицерола. Поэтому существует второй, глицеролфосфатный, путь в шероховатом эндоплазматическом ретикулуме. Источником глицерол-3-фосфата служит окисление глюкозы, так как пищевой глицерол быстро покидает энтероциты и уходит в кровь. Здесь можно выделить следующие реакции: 1. Образование глицерол-3-фосфата из глюкозы. 2.Превращение глицерол-3-фосфата в фосфатидную кислоту. 3.Превращение фосфатидной кислоты в 1,2-ДАГ. 3.Синтез ТАГ.
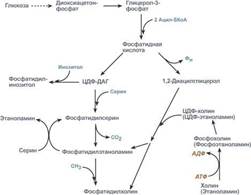
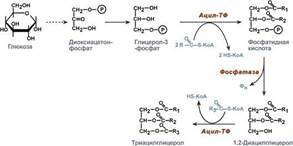 Ресинтез фосфолипидов. Фосфолипиды синтезируются также как и в остальных клетках организма. Для этого есть два способа. Первый – с использованием 1,2-ДАГ и активных форм холина и этаноламина для синтеза фосфатидилхолина или фосфатидилэтаноламина. Второй путь – через синтезируемую in situ фосфатидную кислоту. После ресинтеза фосфолипиды, триацилглицеролы, холестерол и его эфиры упаковываются в особые транспортные формы липидов – липопротеины и только в такой форме они способны покинуть энтероцит. В кишечнике формируются два вида липопротеинов – хиломикроны и липопротеины высокой плотности.
Ресинтез фосфолипидов. Фосфолипиды синтезируются также как и в остальных клетках организма. Для этого есть два способа. Первый – с использованием 1,2-ДАГ и активных форм холина и этаноламина для синтеза фосфатидилхолина или фосфатидилэтаноламина. Второй путь – через синтезируемую in situ фосфатидную кислоту. После ресинтеза фосфолипиды, триацилглицеролы, холестерол и его эфиры упаковываются в особые транспортные формы липидов – липопротеины и только в такой форме они способны покинуть энтероцит. В кишечнике формируются два вида липопротеинов – хиломикроны и липопротеины высокой плотности.
 Поскольку липиды являются в основе своей гидрофобными молекулами, то они транспортируются в водной фазе крови в составе особых частиц – липопротеинов. Такие транспортные липопротеины можно сравнить с орехом, который имеет скорлупу и ядро. Поверхность липопротеиновой частицы ("скорлупа") гидрофильна и сформирована белками, фосфолипидами и свободным холестеролом. Триацилглицеролы и эфиры холестерола составляют гидрофобное ядро. Липопротеины различаются по соотношению триацилглицеролов, холестерола и его эфиров, фосфолипидов и как сложные белки состоят из четырех классов.1. хиломикроны (ХМ), 2.липопротеины очень низкой плотности (ЛПОНП, пре-β-липопротеины, пре-β-ЛП), 3. липопротеины низкой плотности (ЛПНП, β-липопротеины, β-ЛП), 4. липопротеины высокой плотности (ЛПВП, α-липопротеины, α-ЛП). Транспорт триацилглицеролов от кишечника к тканям (экзогенные ТАГ) осуществляется в виде хиломикронов (ХМ), от печени к тканям (эндогенные ТАГ) – в виде липопротеинов очень низкой плотности. В транспорте ТАГ к тканям можно выделить последовательность следующих событий:
Поскольку липиды являются в основе своей гидрофобными молекулами, то они транспортируются в водной фазе крови в составе особых частиц – липопротеинов. Такие транспортные липопротеины можно сравнить с орехом, который имеет скорлупу и ядро. Поверхность липопротеиновой частицы ("скорлупа") гидрофильна и сформирована белками, фосфолипидами и свободным холестеролом. Триацилглицеролы и эфиры холестерола составляют гидрофобное ядро. Липопротеины различаются по соотношению триацилглицеролов, холестерола и его эфиров, фосфолипидов и как сложные белки состоят из четырех классов.1. хиломикроны (ХМ), 2.липопротеины очень низкой плотности (ЛПОНП, пре-β-липопротеины, пре-β-ЛП), 3. липопротеины низкой плотности (ЛПНП, β-липопротеины, β-ЛП), 4. липопротеины высокой плотности (ЛПВП, α-липопротеины, α-ЛП). Транспорт триацилглицеролов от кишечника к тканям (экзогенные ТАГ) осуществляется в виде хиломикронов (ХМ), от печени к тканям (эндогенные ТАГ) – в виде липопротеинов очень низкой плотности. В транспорте ТАГ к тканям можно выделить последовательность следующих событий:
1)Образование незрелых первичных ХМ в кишечнике.
2)Движение первичных ХМ через лимфатические протоки в кровь.
3)Созревание ХМ в плазме крови – получение белков апоС-II и апоЕ от ЛПВП.
4)Взаимодействие с липопротеинлипазой (ЛПЛ) эндотелия, которая отщепляет жирные кислоты от ТАГ. Жирные кислоты переходят непосредственно в данную ткань или, связываясь с альбумином, разносятся по организму. В результате количество ТАГ в хиломикроне резко снижается и образуются остаточные ХМ.
5)Переход остаточных ХМ в гепатоциты и полный распад их структуры.
6)Синтез ТАГ в печени из пищевой глюкозы. Использование ТАГ, пришедших в составе остаточных ХМ.
7)Образование первичных ЛПОНП в печени.
8)Созревание ЛПОНП в плазме крови – получение белков апоС-II и апоЕ от ЛПВП.
9)Взаимодействие с липопротеинлипазой эндотелия и потеря большей части ТАГ. Образование остаточных ЛПОНП (по-другому липопротеины промежуточной плотности, ЛППП).
10)Остаточные ЛПОНП переходят в гепатоциты и полностью распадаются, либо остаются в плазме крови. После воздействия на них печеночной ТАГ-липазы в синусоидах печени ЛПОНП превращаются в ЛПНП.
Характеристика хиломикронов. Общая характеристика: -формируются в кишечнике из ресинтезированных жиров,-в их составе преобладают ТАГ, мало белка, фосфолипидов и холестерола (2% белка, 87% ТАГ, 2% ХС, 5% эфиров ХС, 4% фосфолипидов),-основным апобелком является апоВ-48, это структурный липопротеин, в плазме крови получают от ЛПВП белки апоС-II и апоЕ,- в норме натощак не обнаруживаются, в крови появляются после приема пищи, поступая из лимфы через грудной лимфатический проток, и полностью исчезают через 10-12 часов,-не атерогенны.
Функция: Транспорт экзогенных ТАГ из кишечника в ткани, запасающие или использующие жиры, в основном жировую ткань, легкие, печень, миокард, лактирующую молочную железу, костный мозг, почки, селезенку, макрофаги. На эндотелии капилляров этих тканей имеется фермент липопротеинлипаза.
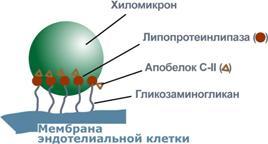 Метаболизм 1. После ресинтеза жиров в эпителиоцитах кишечника формируются первичные хиломикроны, имеющие только апоВ-48.
Метаболизм 1. После ресинтеза жиров в эпителиоцитах кишечника формируются первичные хиломикроны, имеющие только апоВ-48.
2. Из-за большого размера они не проникают напрямую в кровеносное русло и эвакуируются через лимфатическую систему, попадая в кровь через грудной лимфатический проток.
3. В крови хиломикроны взаимодействуют с ЛПВП и приобретают от них апоС-II и апоЕ, образуя зрелые формы. Белок апоС-II является активатором фермента липопротеинлипазы, белок апоЕ необходим для удаления из крови остаточных хиломикронов.
4. На эндотелии капилляров вышеперечисленных тканей находится фермент липопротеинлипаза (ЛПЛ), отщепляющий жирные кислоты от ТАГ. Количество фермента увеличивается при действии инсулина и прогестерона.
5. После взаимодействия хиломикрона с ферментом триацилглицеролы, находящиеся в составе хиломикронов, гидролизуются с образованием свободных жирных кислот. Жирные кислоты перемещаются в клетки органа, либо остаются в плазме крови и в комплексе с альбумином разносятся с кровью в другие ткани. Липопротеинлипаза способна удалить до 90% всех ТАГ, находящихся в хиломикроне или ЛПОНП.
6. После окончания работы ЛПЛ остаточные хиломикроны попадают в гепатоциты посредством апоЕ-рецепторного эндоцитоза и разрушаются.
Содержание липидов в кровотоке может понижаться вследствие откладывания их в различных тканях. Способность откладывать жир характерна для всех тканей, кроме мозга. Главную роль в обмене липидов играют жировая ткань и печень. Количество жировой ткани нарастает с возрастом. Пределы конц жиров в крови:Норма-4-8г/л, если больше-гиперлипемия(при сах диабете, ожирении). В норме концентрация жиров в крови колеблется в довольно широких пределах — 10-200 мг/дл, в среднем около 0,1 %. Отметим для сравнения, что концентрация жиров в молоке равна примерно 3 %. После приема пищи концентрация хиломикронов в крови повышается, достигает максимума примерно через 5 ч, затем начинает снижаться. Сходным образом, но с меньшей амплитудой изменяется концентрация ЛОНП в крови. При этом надо отметить, что концентрация хиломикронов в большей мере зависит от содержания жиров в пище, а концентрация ЛОНП — от содержания углеводов. В крови, взятой для анализа утром до завтрака, т. е. после большого ночного перерыва в приеме пищи, хиломикроны не обнаруживаются, а концентрация ЛОНП минимальна. Пропорционально концентрации этих липопротеинов снижена и концентрация жиров в крови.При обычном ритме питания и небольших физических нагрузках в крови в дневное время постоянно имеются хиломикроны и ЛОНП, поскольку время переваривания жиров мало отличается от времени между приемами пищи.
Любое нарушение внешнего обмена липидов (проблемы переваривания или всасывания) проявляется увеличением содержания жира в кале – развивается стеаторея. Причины:
1. Снижение желчеобразования в результате недостаточного синтеза желчных кислот и фосфолипидов при болезнях печени, гиповитаминозах.
2. Снижение желчевыделения (обтурационная желтуха, билиарный цирроз, желчнокаменная болезнь). У детей часто причиной может быть перегиб желчного пузыря, который сохраняется и во взрослом состоянии.
3. Снижение переваривания при недостатке панкреатической липазы, который возникает при заболеваниях поджелудочной железы (острый и хронический панкреатит, острый некроз, склероз). Может возникать относительная недостаточность фермента при сниженном выделении желчи.
4. Избыток в пище катионов кальция и магния, которые связывают жирные кислоты, переводят их в нерастворимое состояние и препятствуют их всасыванию. Эти ионы также связывают желчные кислоты, нарушая их работу.
5. Снижение всасывания при повреждении стенки кишечника токсинами, антибиотиками (неомицин, хлортетрациклин).
6. Недостаточность синтеза пищеварительных ферментов и ферментов ресинтеза липидов в энтероцитах при белковой и витаминной недостаточности.
22. Окисление глицерина и высших жирных к-т. Последовательность реакций. Связь β-окисления с циклом Кребса и дых цепью. Физиологическое значение окисления жирных кислот в зависимости от ритма питания и мышечной активности.
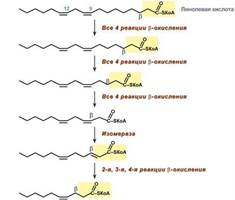
 Для преобразования энергии, заключенной в жирных кислотах, в энергию связей АТФ существует метаболический путь окисления жирных кислот до СО2 и воды, тесно связанный с циклом трикарбоновых кислот и дыхательной цепью. Этот путь называется β-окисление, т.к. происходит окисление 3-го углеродного атома жирной кислоты (β-положение) в карбоксильную группу, одновременно от кислоты отщепляется ацетильная группа, включающая С1 и С2 исходной жирной кислоты. Реакции β-окисления происходят в митохондриях большинства клеток организма (кроме нервных клеток). Для окисления используются жирные кислоты, поступающие в цитозоль из крови или появляющиеся при липолизе собственных внутриклеточных ТАГ. Суммарное уравнение окисления пальмитиновой кислоты выглядит следующим образом: Пальмитоил-SКоА + 7ФАД + 7НАД+ + 7Н2O + 7HS-KoA → 8Ацетил-SКоА + 7ФАДН2 + 7НАДН
Для преобразования энергии, заключенной в жирных кислотах, в энергию связей АТФ существует метаболический путь окисления жирных кислот до СО2 и воды, тесно связанный с циклом трикарбоновых кислот и дыхательной цепью. Этот путь называется β-окисление, т.к. происходит окисление 3-го углеродного атома жирной кислоты (β-положение) в карбоксильную группу, одновременно от кислоты отщепляется ацетильная группа, включающая С1 и С2 исходной жирной кислоты. Реакции β-окисления происходят в митохондриях большинства клеток организма (кроме нервных клеток). Для окисления используются жирные кислоты, поступающие в цитозоль из крови или появляющиеся при липолизе собственных внутриклеточных ТАГ. Суммарное уравнение окисления пальмитиновой кислоты выглядит следующим образом: Пальмитоил-SКоА + 7ФАД + 7НАД+ + 7Н2O + 7HS-KoA → 8Ацетил-SКоА + 7ФАДН2 + 7НАДН
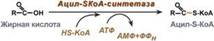 Этапы окисления жирных кислот: 1. Прежде, чем проникнуть в матрикс митохондрий и окислиться, жирная к-та должна активироваться в цитозоле. Это осуществляется присоединением к ней коэнзима А с обр-ем ацил-S-КоА. Ацил-S-КоА яв-ся высокоэнергетическим соед-ем. Необратимость реакции достигается гидролизом дифосфата на 2 молекулы фосфорной к-ты.
Этапы окисления жирных кислот: 1. Прежде, чем проникнуть в матрикс митохондрий и окислиться, жирная к-та должна активироваться в цитозоле. Это осуществляется присоединением к ней коэнзима А с обр-ем ацил-S-КоА. Ацил-S-КоА яв-ся высокоэнергетическим соед-ем. Необратимость реакции достигается гидролизом дифосфата на 2 молекулы фосфорной к-ты.
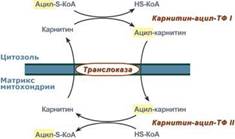 2. Ацил-S-КоА не способен проходить через митохондриальную мембрану, поэтому существует способ его переноса в комплексе с витаминоподобным веществом карнитином. На наружной мембране митохондрий имеется фермент карнитин-ацилтрансфераза I.
2. Ацил-S-КоА не способен проходить через митохондриальную мембрану, поэтому существует способ его переноса в комплексе с витаминоподобным веществом карнитином. На наружной мембране митохондрий имеется фермент карнитин-ацилтрансфераза I.
Карнитин синтезируется в печени и почках и затем транспортируется в остальные органы. Во внутриутробном периоде и в первые годы жизни значение карнитина для организма чрезвычайно важно. Энергообеспечение нервной системы детского организма и, в частности, головного мозга осуществляется за счет 2х параллельных процессов: карнитин-зависимого ок-ия жирных к-т и аэробного окисления глюкозы. Карнитин необходим для роста головного и спинного мозга, для вз-вия всех отделов НС, ответственных за движение и взаимодействие мышц. Сущ-ют исследования, связывающие с недостатком карнитина детский церебральный паралич и феномен "смерти в колыбели".
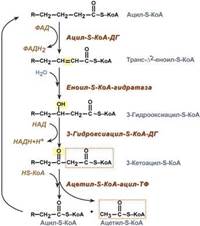 3. После св-ия с карнитином ж к-та переносится ч/з мембрану транслоказой. Здесь на внутренней стороне мембраны фермент карнитин-ацилтрансфераза II вновь обр-ет ацил-S-КоА кот вступает на путь β-окисления.
3. После св-ия с карнитином ж к-та переносится ч/з мембрану транслоказой. Здесь на внутренней стороне мембраны фермент карнитин-ацилтрансфераза II вновь обр-ет ацил-S-КоА кот вступает на путь β-окисления.
4. Процесс собственно β-окисления состоит из 4-х реакций, повторяющихся циклически. В них последовательно происходит окисление (ацил-SКоА-дегидрогеназа), гидратирование (еноил-SКоА-гидратаза) и вновь окисление 3-го атома углерода (гидроксиацил-SКоА-дегидрогеназа). В последней, трансферазной, реакции от жирной кислоты отщепляется ацетил-SКоА. К оставшейся (укороченной на два углерода) жирной кислоте присоединяется HS-КоА, и она возвращается к первой реакции. Все повторяется до тех пор, пока в последнем цикле не образуются два ацетил-SКоА.
Расчет энергетического баланса β-окисления: При расчете количества АТФ, образуемого при β-окислении жирных кислот необходимо учитывать:
*количество образуемого ацетил-SКоА – определяется обычным делением числа атомов углерода в жирной кислоте на 2;
 *число циклов β-окисления. Число циклов β-окисления легко определить исходя из представления о жирной кислоте как о цепочке двухуглеродных звеньев. Число разрывов между звеньями соответствует числу циклов β-окисления. Эту же величину можно подсчитать по формуле (n/2 -1), где n – число атомов углерода в кислоте,
*число циклов β-окисления. Число циклов β-окисления легко определить исходя из представления о жирной кислоте как о цепочке двухуглеродных звеньев. Число разрывов между звеньями соответствует числу циклов β-окисления. Эту же величину можно подсчитать по формуле (n/2 -1), где n – число атомов углерода в кислоте,
 *число двойных связей в жирной кислоте. В первой реакции β-окисления происходит образование двойной связи при участии ФАД. Если двойная связь в жирной кислоте уже имеется, то необходимость в этой реакции отпадает и ФАДН2 не образуется. Количество необразованных ФАДН2 соответствует числу двойных связей. Остальные реакции цикла идут без изменений;
*число двойных связей в жирной кислоте. В первой реакции β-окисления происходит образование двойной связи при участии ФАД. Если двойная связь в жирной кислоте уже имеется, то необходимость в этой реакции отпадает и ФАДН2 не образуется. Количество необразованных ФАДН2 соответствует числу двойных связей. Остальные реакции цикла идут без изменений;
*количество энергии АТФ, потраченной на активацию (всегда соответствует двум макроэргическим связям).
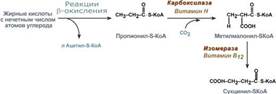
Окисление жирных кислот с нечетным числом углеродных атомов. Ж к-ты с нечетным числом углеродов поступают в организм с растительной пищей и морепродуктами. Их окисление происходит по обычному пути до последней реакции, в которой обр-ся пропионил-SКоА. Суть превращений пропионил-SКоА сводится к его карбоксилированию, изомеризации и обр-ию сукцинил-SКоА. В этих реакциях участвуют биотин и В12.
Окисление ненасыщенных жирных кислот. При окислении ненасыщенных жирных кислот возникает потребность клетки в дополнительных ферментах изомеразах. Эти изомеразы перемещают двойные связи в жирнокислотных остатках из γ- в β-положение и переводят природные двойные связи из цис- в транс-положение. Т.о., уже имеющаяся двойная связь готовится к β-окислению и пропускается первая реакция цикла, в которой участвует ФАД.
Глицерин – трехатомный спирт, водорастворим и легко всасывается из кишечника и по воротной вене поступает в печень. Окисление глицерина
Глицерин сначала фосфорилируется с участием АТФ до глицерофосфата (3-фосфоглицерол). Затем под действием НАД-зависимой глицерофосфатдегидрогеназы окисляется до 3-фосфоглицеринового альдегида. Фосфоглицериновый альдегид далее может окисляться до пировиноградной и молочной кислоты.
Связь в-окисления с ЦК и Дц: Таким образом, молекула жирной кислоты в конце концов распадается до продуктов, имеющих всего два углеродных атома, превращающихся в цикле трикарбоновых кислот. Восстановленные коферменты впоследствии вновь окисляются в дыхательной цепи с одновременным образованием макроэргических фосфатов. С точки зрения образования АТР, окисление жирных кислот составляет основной энергетический резерв организма.
Регуляция в-окисления: Ключевой фермент – карнитинацилтрансфераза1, аллостерический фермент, в печени его аллостерический ингибитор – малонилКоА. Активируют: катехоламины, СТГ, глюкагон. Ингибирует: инсулин.
Е значение в-окисление имеет для скелетных мышц (50% Е), для сердечной мышцы (70%), головной мозг и другие нервные ткани, а также эритроциты не используют жирные к-ты для окисления; они не поступают в головной мозг, т.к. не проходят ч/з гематоэнцефалический барьер.
23. Липолиз и липогенез. Значение. Зависимость липогенеза от ритма питания и состава пищи. Регуляция липолиза и липогенеза. Транспорт и использование жирных кислот, образующихся при мобилизации жира.
Синтезируясь во время и сразу после приема пищи (липогенез) и запасаясь в жировой ткани, триацилглицеролы являются формой хранения насыщенных и мононенасыщенных жирных кислот. Распад триацилглицеролов (триглицеридов) по-другому называется липолиз или мобилизация жира. Он идет в жировых клетках постоянно и обычно существует равновесие между синтезом и распадом ТАГ.
Даже в состоянии покоя организма печень, сердце, скелетные мышцы и другие ткани (кроме эритроцитов и нейроцитов) более 50% энергии получают из окисления жирных кислот, поступающих из жировой ткани благодаря фоновому липолизу. По мере уменьшения резервов глюкозы клетки все больше энергии получают из окисления жирных кислот. Таким образом, насыщенные жирные кислоты выполняют роль своеобразного буфера энергии в организме. Мобилизация триацилглицеролов и окисление жирных кислот активируется при нормальных физиологических стрессовых ситуациях – эмоциональный стресс, мышечная работа, голодание, при патологических состояниях – сахарный диабет I типа, другие гормональные заболевания (гиперкортицизм, гипертир
 2015-06-16
2015-06-16 11861
11861
