1. Причина образования химической связи - это:
1) уменьшение энергии системы
2) обобществление валентных электронов
3) наличие неспаренных электронов у взаимодействующих атомов
4) наличие гибридных атомных орбиталей (АО) у взаимодействующих атомов
2. s- связь образуется в результате перекрывания АО:
1) на прямой, соединяющей ядра атомов
2) вне прямой, соединяющей ядра атомов (выше и ниже прямой)
3) под определенным углом друг к другу
4) любым из перечисленных выше способов
3. Полярность связи зависит от:
1) энергии связи
2) типа гибридизации АО
3) типа связи (s или p)
4) относительной электроотрицательности атомов
4. Понятие «строение молекулы»-это:
1) геометрическая конфигурация ядер атомов
2) распределение электронной плотности в молекуле
3) распределение электронов по молекулярным орбиталям
4) способ описания молекулы как системы, состоящей из ядер и электронов
5. Какое утверждение является ошибочным: ковалентная связь характеризуется:
1) энергией
2) длиной
3) ненасыщаемостью
4) направленностью
6. Степень окисления атома – это
1) частичный заряд атома в молекуле
2) число химических связей, образованных атомом в молекуле
3) заряд атома в молекуле, вычисленный в предположении, что все связи – ионные
4) окислительный потенциал атома, возведенный в некоторую степень
7. В каком из соединений хлор имеет наибольшую степень окисления?
1) SOCl2
2) HClO
3) KClO4
4) Cl2
8. Пара соединений, все связи в которых – ковалентные:
1) NaCl, HCl
2) CO2, PbO2
3) CH3Cl, CH3COONa
4) SO2, NO2
9. Электроотрицательность элементов в ряду Si – P – S – Cl:
1) возрастает
2) убывает
3) не изменяется
4) сначала возрастает, а затем остается постоянной
10. Молекулы какого из перечисленных веществ имеют наименьшую энергию связи
1) HI
2) HBr
3) HCI
4) HF
11. Атом углерода имеет три s- связи в молекуле
1) CO
2) CO2
3) HCOOH
4) CH3Cl
12. Сколько электронов участвуют в образовании химических связей в молекуле аммиака?
1) 8
2) 6
3) 10
4) 2
13. Какой тип связи в молекуле Н2?
1) водородная
2) ковалентная неполярная
3) донорно-акцепторная
4) ионная
14. Какое утверждение ошибочно: в ионе NH4+
1) одна из химических связей образована по донорно-акцепторному механизму
2) гибридизация атомных орбиталей азота- sp3
3) геометрия-тетраэдрическая
4) положительный заряд сосредоточен на одном из атомов водорода
15. Атом алюминия в анионе Al(OH)63- находится в
1) sp3-гибридном состоянии
2) dsp2-гибридном состоянии
3) dsp3-гибридном состоянии
4) sp3d2-гибридном состоянии
16. Кратность связи С-С в молекуле C2H4 равна:
1) 1
2) 1,5
3) 2
4) 3
17. Как связаны степень окисления и валентность атома?
1) степень окисления всегда меньше валентности
2) степень окисления может быть равна валентности
3) степень окисления всегда больше валентности
4) это одно и тоже
18. Какое утверждение ошибочно: при образовании химической связи происходит
1) притяжение электронов одних атомов к ядрам других атомов
2) увеличение энергии системы
3) обобществление электронных пар различными атомами
4) образование молекулярных орбиталей из атомных
19. Разрушение химической связи – процесс, который …
1) сопровождается выделением энергии
2) происходит самопроизвольно в изолированных системах
3) требует затраты энергии
4) может происходить только под действием света
20. Кратность связи – это число:
1) связей, образованных перекрыванием гибридных атомных орбиталей(АО)
2) s-связей между двумя атомами
3) p-связей между двумя атомами
4) s- и p-связей между двумя атомами
21. Валентность и степень окисления кислорода в молекуле пероксида водорода соответственно равны:
1) I и -2
2) II и -2
3) II и +1
4) II и -1
22. Сколько электронов содержится в молекуле воды?
1) 10
2) 3
3) 18
4) 16
23. В каком ряду молекулы расположены в порядке увеличения полярности связей?
1) HF, HCl, HBr
2) NH3, PH3, AsH3
3) H2Se, H2S, H2O
4) CO2, CS2, CSe2
24. Элементы с электронной конфигурацией 4s² и 2s² 2p³ валентных электронов образуют между собой химическую связь:
1) металлическую
2) ковалентную неполярную
3) ковалентную полярную
4) ионную
25. Атомы химических элементов IV периода образуют соединение с ионной химической связью:
1) KBr
2) AsH3
3) H2Se
4) Mn2O7
26. Связь в соединении, образованном атомом Н и элементом, имеющим распределение электронов в атоме 2, 8, 6 является:
1) ионной
2) ковалентной полярной
3) ковалентной неполярной
4) металлической
27. Наиболее прочная химическая связь имеет место в молекуле
. 1) CH4
2) C2H6
3) C2H4
4) C2H2
28. Какое из перечисленных соединений не имеет sp3 -гибридизацию центрального атома:
1) NH3
2) BH3
3) H2O
4) СН4
29. Кратность связи N-N в молекуле N2H4
1) 1
2) 1,33
3) 1,5
4) 2
30. Геометрическая форма молекулы CO2
1) линейная
2) треугольная
4) пирамидальная
5) уголковая
31. Какое утверждение ошибочно: в ионе AlH4-
1) атомные орбитали алюминия находятся в dsp2-гибридном состоянии
2) отрицательный заряд делокализован по всем атомам водорода
3) геометрия-тетраэдрическая
4) одна (или несколько связей) образована по донорно-акцепторному механизму
32. Ковалентная связь образуется:
1) электростатическим взаимодействием противоположно заряженных ионов
2) обобществлением пары электронов с антипараллельными спинами
3) обобществлением пары электронов с параллельными спинами
4) одним электроном между двумя атомами
33. Полярность связи можно количественно оценить:
1) дипольным моментом и эффективным зарядом
2) поляризуемостью
3) степенью окисления атомов
4) энергией связи
34. В ряду H2O – H2S – H2Se – H2Te увеличивается:
1) полярность связи
2) энергия связи
3) длина связи
4) прочность связи
35. Электроотрицательность элементов по ряду Cl – Br –I – At
1) возрастает
2) убывает
3) не изменяется
4) сначала возрастает, а затем остается постоянной
36. Какой из перечисленных элементов может иметь в соединениях как положительную, так и отрицательную степень окисления?
1) аргон
2) фтор
3) бром
4) железо
37. В каком случае типы связей расположены по мере убывания их энергии?
1) Ван-дер-ваальсова, металлическая
2) водородная, ионная
3) ковалентная, водородная
4) водородная, ковалентная неполярная
38. Ионный характер связи наиболее выражен в соединении
1) H2O
2) CaO
3) CO2
4) CrO3
39. Элементы с электронной конфигурацией валентных электронов 4s¹ и 3s² 3р5
образуют между собой химическую связь:
1) металлическую
2) ковалентную неполярную
3) ковалентную полярную
4) ионную
40. Сколько электронов участвуют в образовании химических связей в молекуле метана?
1) 8
2) 6
3) 10
4) 2
41. Соединением с ковалентной неполярной связью является:
1) CrO3
2) P2O5
3) SO2
4) F2
42. Между атомами водорода и углерода образуется
1) σ- связь
2) π - связь
3) двойная (σ и π)
4) тройная (σ и 2π)
43. В какой частице есть связь, образованная по донорно-акцепторному механизму?
1) О2
2) SО3
3) Н3О+
4) Н2О2
44. Какое пространственное строение может иметь молекула, центральный атом которой находится в sp2-гибридном состоянии?
1) тетраэдр
2) равносторонний или равнобедренный треугольник
3) треугольная пирамида
4) плоский квадрат
45. Кратность связи N-N в молекуле N2 равна:
1) 1
2) 2
3) 2,5
4) 3
46. Геометрическая форма молекулы BCl3
1) линейная
2) треугольная
3) тетраэдрическая
4) пирамидальная
47. Тип гибридизации атомных орбиталей углерода в молекуле HCN
1) sp3
2) sp2
3) sp
4) sp2d
48. Какое утверждение ошибочно: в ионе Н3О+:
1) атом кислорода находится в состоянии sp3-гибридизации
2) геометрическая форма -пирамида
3) положительный заряд сосредоточен на атоме кислорода
4) кратность связи равна 1
49. При образовании химической связи электронная плотность между взаимодействующими атомами
1) уменьшается
2) увеличивается
3) исчезает
4) не изменяется
50. Условием образования ковалентной химической связи является:
1) обязательное возбужденное состояние хотя бы одного из атомов
2) наличие у взаимодействующих атомов неспаренных электронов с антипараллельными спинами
3) наличие гибридных атомных орбиталей у взаимодействующих атомов
4) появление эффективных зарядов на взаимодействующих атомах
51. Ионная связь не обладает
1) длиной
2) энергией
3) насыщаемостью
4) прочностью
52. Температура кипения воды выше,чем температура кипения сероводорода,потому что
1) кислород имеет меньший радиус атома
2) у атома кислорода отсутствуют d-орбитали
3) вода имеет меньшую молекулярную массу
4) молекулы воды связаны водородными связями
53. В каком из перечисленных веществ есть водородные связи?
1) СН4
2) С6Н5ОН
3) NH4Cl
4) CH3COONa
54. Валентность азота меньше его степени окисления (по абсолютной величине) в молекуле
1) аммиака
2) азотной кислоты
3) азота
4) оксида азота (II)
55. Электроотрицательность элементов по ряду N – P – As – Sb:
1) возрастает
2) убывает
3) не изменяется
4) сначала возрастает, а затем остается постоянной
56. Какое утверждение ошибочно: связь О-О в молекуле Н2О2:
1) ковалентная
2) неполярная
3) одинарная(s)
4) двойная(s,p)
57. Ионный характер связи наиболее выражен в соединении
1) CCl4
2) SiO2
3) CaBr2
4) NH3
58. Элементы с электронной конфигурацией валентных электронов2s²2p2 и 3s² 3p2
образуют между собой химическую связь:
1) металлическую
2) ковалентную неполярную
3) ковалентную полярную
4) ионную
59. Одна связь (или несколько)образована по донорно-акцепторному механизму в:
1) PCl5
2) POCl3
3) PH3
4) PH4+
60. Число σ-связей в молекуле C2H6:
1) 4
2) 5
3) 6
4) 7
61. Кратность связи С-O в молекуле оксида углерода (II)
1) 1
2) 2
3) 2,5
4) 3
62. Геометрическая форма молекулы CH4 и гибридизация атомных орбиталей углерода:
1) октаэдрическая; sp3d2- гибридизация атомных орбиталей
2) треугольная; sp3- гибридизация атомных орбиталей
3) тетраэдрическая; sp3 - гибридизация атомных орбиталей
4) пирамидальная; sp3 - гибридизация атомных орбиталей
63. Угол между связями (валентный) в молекуле NH3 и гибридизация атомных орбиталей азота соответственно:
1) 109о28; sp3
2) 104о5; sp3
3) 107о; sp3
4) 120о; sp2
64. Как меняется прочность ковалентной связи Н-Э в ряду H2O → H2S → H2Sе → H2Те
1) прочность связи возрастает
2) уменьшается
3) не изменяется
4) растет, затем уменьшается
65. К веществам с ионным типом химической связи относятся:
1) КCl
2) NO2
3) CH3COOH
4) PF5
66. Укажите, молекулы каких соединений из приведенного ряда способны ассоциироваться за счет водородных связей:
1) CCl4, CH4, CaF2
2) CHCl3, H2CO3, NaOH
3) H2O, HF, C2H5OH
4) CH4, CaF2, H2CO3
67. Укажите, какие атомы могут участвовать в образовании донорно- акцепторной связи;
1) K, Br, Na, Cl
2) Be, B, O, Nа
3) Cu, Fe, Zn, Al
4) H, C, Cu, I
68. Механизм образования химической связи между металлом-комплексообразователем и лигандами в комплексных соединениях:
1) обменный;
2) радикальный
3) ионный.
4) донорно-акцепторный;
69. Кратность связи в молекуле определяется:
1) числом электронов между двумя атомами;
2) числом p-связей;
3) количеством электронных пар между двумя атомами
4) количеством электронов у двух атомов
70. Вещества, имеющие только sp3 гибридизацию атомных орбиталей приведены в ряду:
1) ССl4 C2H6 SiH4
2) C2H2 CH4 BF3
3) NH3 C2H4 H2O2
4) H2O BH3 CaCl2
71. Кратность связи равна 3 в молекуле:
1) O2
2) H2
3) O3
4) N2
72. Природа связи в хлориде калия:
1) ионная;
2) ковалентная неполярная;
3) металлическая.
4) донорно- акцепторная
73. Электронная конфигурация 1s1 соответствует атому элемента:
1) азот
2) кислород
3) кремний
4) водород
74. Вещества, содержащие только ковалентные полярные химические связи, приведены в ряду:
1) NO2, SOCl2, P2O5
2) Fe, H2SO4, CH3COOH
3) PF5, Cl2O7, NH4Cl
4) H3PO4, BF3, CH3COONH4
75. Выберите блок молекул, которые образуют межмолекулярную водородную связь
1) H2O, HF, C2H5OH
2) C6H6, Cl2, NH3
3) C2H6, C6H5-CH3, C2H5- O- C2H5,
4) C6H12O6, CO2, HC≡N
76. Донорно-акцепторный механизм образования связи характерен для:
1) кислых солей 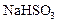 ;
;
2) основных солей 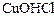 ;
;
3) комплексного иона 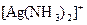 .
.
4) аминокислот
77. Комплексообразователем в молекуле гемоглобина является ион:
1) 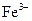 ;
;
2) 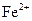 ;
;
3) 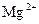 .
.
4) 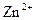
78. Что собой представляет гемоглобин (НЬ) по химической природе:
1)Hb – сложный белок, содержащий хелатный макроцикл гем с железом в степени окисления +2;
2)Hb – кислый белок, содержащий небелковую часть - гем с железом в степени окисления +3;
3)Нb – транспортная форма кислорода, содержащая атом железа в нейтральном состоянии.
4)Hb – сильный электролит
79. Почему нитриты токсичны:
1)окисляют аминогруппы нуклеиновых кислот;
2)превращают Hb в метHb;
3)окисляют аминогруппы нуклеиновых кислот и превращают НЬ в метHb;
4)блокируют карбоксипептидазу?
80. На чем основано бактерицидное действие пероксида водорода:
1)на превращении метНЬ в НЬ;
2)на сильной восстановительной способности;
3)на окислительной спосо6ности пероксида водорода
4)на усилении гидролиза АТФ
 2015-06-24
2015-06-24 4057
4057