1. Аминный азот сыворотки крови
2. Общий белок сыворотки крови
3. Альбумины сыворотки крови
4. Глобулины сыворотки крови
5. Альбумино-глобулиновый коэффициент сыворотки крови
6. Остаточный азот сыворотки крови и его компоненты
7. Мочевина сыворотки крови
8. Мочевина мочи
9. Глюкоза крови
10. Порог почечной проницаемости для глюкозы (кровь)
11. Сиаловые кислоты (сыворотка)
12. Кетоновые тела сыворотки крови
13. Общие липиды сыворотки крови
14. Липоротеины общие сыворотки крови
15. Общий холестерин сыворотки крови
16. Общий билирубин сыворотки крови
17. рН крови
18. Буферные основания (плазма крови)
19. Сдвиг буферных оснований
20. Креатинин (моча)
21. Общая кислотность желудочного сока (его составные части)
22. Амилаза сыворотки крови
23. Трансаминазы (АсАТ и АлАТ) сыворотки крови
24. Щелочная фосфатаза сыворотки крови
25. Кальций сыворотки крови
26. Хлориды (кровь)
1. Предмет и задачи биологической химии. Обмен веществ и энергии, иерархическая структурная организация и самовоспроизведение как важнейшие признаки живой материи.
Биологическая химия —это наука о молекулярной сущности жизни. Она изучает химическую природу веществ, входящих в состав живых организмов, их превращения, а также связь этих превращений с деятельностью клеток, органов и тканей и организма в целом. Из этого определения вытекает, что биохимия занимается выяснением химических основ важнейших биологических процессов и общих путей и принципов превращений веществ и энергии, лежащих в основе разнообразных проявлений жизни. Таким образом, главной задачей биохимии является установление связи между молекулярной структурой и биологической функцией химических компонентов живых организмов.
Наиболее важными и приоритетными фундаментальными направлениями научных исследований в биохимии и молекулярной биологии являются генетическая инженерия и биотехнология, которым придается исключительное значение. Усилия ученых сосредоточены на создании и производстве препаратов для медицины (гормоны, ферменты, моноклональные антитела, биоактивные пептиды, вакцины, интерферон, простагландины и др.), сельского хозяйства (регуляторы роста растений, феромоны для борьбы с вредителями растений), промышленности (пищевые и вкусовые добавки). Эта новая технология может решать ряд важных проблем в медицине (пренатальная диагностика болезней, генотерапия и др.).
В настоящее время перед биологической наукой поставлена задача — обеспечить преимущественное развитие научных исследований по следующим основным направлениям: разработка методов генетической и клеточной инженерии, создание на их основе новых процессов для биотехнологических производств с целью получения принципиально новых пород животных, форм растений с ценными признаками; разработка новых методов и средств диагностики, лечения и профилактики наследственных заболеваний; разработка научных основ инженерной энзимологии; разработка и внедрение новых биокатализаторе в (в том числе иммобилизованных) и оптимизация с их помощью биотехнологических процессов получения химических и пищевых продуктов; исследования структуры и функции биомолекул клетки; изучение молекулярных и клеточных основ иммунологии, а также генетики микроорганизмов и вирусов, вызывающих заболевания человека и животных, создание методов и средств диагностики, лечения и профилактики этих заболеваний; исследования молекулярно-биологиче-ских механизмов канцерогенеза, природы онкогенов и онкобелков, их роли в малигнизации клеток и создание на этой основе методов диагностики и лечения опухолевых заболеваний человека; исследования проблем биоэнергетики, питания, психики и молекулярных основ памяти и деятельности мозга. Таким образом, можно наметить следующие главные направления развития исследований в области биологической химии на ближайшую и отдаленную перспективу, так называемые горизонты биохимии:
1. Дифференцировка клеток высших организмов (эукариот).
2. Организация и механизм функционирования генома.
3. Регуляция действия ферментов и теория энзиматического катализа.
4. Процессы узнавания на молекулярном уровне.
5. Молекулярные основы соматических и наследственных заболеваний человека.
6. Молекулярные основы злокачественного роста.
7. Молекулярные основы иммунитета.
9. Молекулярные механизмы памяти.
10. Биосинтез белка.
11. Биологические мембраны и биоэнергетика.
Основное назначение биологической химии сводится к тому, чтобы решать на молекулярном уровне задачи фундаментальные, общебиологические, включая проблему зависимости человека от экосистемы, которую необходимо не только понимать, но защищать и научиться разумно ею пользоваться.
Важнейшим признаком всего живого является обмен веществ. Обмен веществ обеспечивает присущее живому организму как системе динамическое равновесие, при котором взаимно уравновешиваются синтез и разрушение, размножение и гибель. В основе реакций обмена веществ лежат физико-химические взаимодействия между атомами и молекулами, подчиняющиеся единым для живой и неживой материи законам. Сказанное означает, что сама возможность существования жизни, в первооснове своей, сводится к элементарным актам физико-химических процессов. Обмен веществ состоит из двух противоположных, одновременно протекающих процессов. Первый — анаболизм — объединяет все реакции, связанные с синтезом необходимых веществ, их усвоением и использованием для роста, развития и жизнедеятельности организма. Второй — катаболизм — включает реакции, связанные с распадом веществ, их окислением и выведением из организма продуктов распада. В целом же, обмен веществ представляет собой комплекс биохимических и энергетических процессов, обеспечивающих использование пищевых веществ для нужд организма и удовлетворения его потребностей в пластических и энергетических веществах.
Живой организм – сложная, упорядоченная иерархическая структурная организация. Уровень организации живой материи повышается в ходе эволюции. Формирование каждой следующей ступени иерархии уровней происходит на основе предыдущей, которая структурно в неё входит. Существует множество теорий о структурной организации живой материи. Наиболее известная из них оценивает иерархию по критерию масштабности. Согласно ей, жизнь имеет следующие уровни организации:
1. Молекулярный уровень - отражает особенности химизма живого вещества, а также механизмы и процессы передачи генной информации
2. Клеточный и субклеточный уровни - отражают особенности специализации клеток, а также внутриклеточные структуры. На этом уровне происходят процессы жизнедеятельности (обмен веществ, питание, дыхание, раздражимость и т. д.)
3. Организменный и органно - тканевый уровни - отражают признаки отдельных особей, их строение, физиологию, поведение, а также строение и функции органов и тканей живых существ
4. Популяционно - видовой уровень - образуется свободно скрещивающимися между собой особями одного и того же вида, совокупность особей одного вида
5. Уровень биогеоценозов - структуры, состоящие из участков Земли с определенным составом живых и неживых компонентов, представляющих единый природный комплекс – экосистему
6. Биосферный - вся совокупность живых организмов Земли вместе с окружающей их природной средой
Еще одним качеством, благодаря которому возможна жизнь - это свойство живых организмов к самовоспроизведению. Самовоспроизведение свойственно целым организмам, отдельным их органам, тканям, клеткам, клеточным включениям и многим органеллам. Самовоспроизведение осуществляется посредством вегетативного, полового и бесполого размножений, у животных - путем деления, живорождения, яйцерождения и яйцеживорождения. В основе самовоспроизведения лежит образование новых молекул и структур, которое обусловлено информацией, заложенной в нуклеиновой кислоте ДНК,. Самовоспроизведение тесно связано с явлением наследственности: любое живое существо рождает себе подобных, путем реализации механизма матричного синтеза ДНК.
2. Гетеротрофные и аутотрофные организмы: различия по питанию и источникам энергии. Катаболизм и анаболизм.
Живые клетки постоянно нуждаются в органических и неорганических веществах, а также в химической энергии, которую они получают преимущественно из АТФ (АТР). По способу удовлетворении этих потребностей организмы подразделяются на автотрофные и гетеротрофные. Автотрофные организмы, к которым принадлежат растения и многие микроорганизмы, могут синтезировать органические молекулы из неорганических предшественников в процессах хемо- и фотосинтеза. Автотрофы обеспечивают существование все других организмов на планете.
Гетеротрофы, например животные и грибы, зависят от получения органических веществ с пищей. Так как большая часть этих питательных веществ (белки, углеводы, нуклеиновые кислоты и липиды) не могут утилизироваться непосредственно, они сначала разрушаются до более мелких фрагментов катаболическим путем. Возникающие метаболиты (в совокупности их называют иногда «пулом метаболитов») затем катаболизируются с высвобождением свободной энергии или используются в анаболических путях для синтеза более сложных молекул.
Процесс обмена веществ определяется двумя сопряженными процессами: анаболизма и катаболизма.
Анаболизм - совокупность химических процессов синтеза собственных органических соединений из полученных питательных веществ, идущий с потреблением энергии. В результате такого обмена из питательных веществ, поступающих в организм, строятся свойственные организму структурные молекулы, которые, в свою очередь, идут уже на создание новых функциональных единиц живого организма, что является основой ассимиляции.
Катаболизм - процесс метаболического распада, разложения на более простые вещества или окисления какого-либо вещества, обычно протекающий с высвобождением энергии в виде тепла и в виде АТФ. Катаболические реакции лежат в основе диссимиляции: утраты сложными веществами своей специфичности для данного организма в результате распада до более простых.
3. Многомолекулярные системы (метаболические цепи, мембранные процессы, системы синтеза биополимеров, молекулярные регуляторные системы) как основные объекты биохимического исследования.
Как известно, биохимия - это наука изучающая химическую основу жизни как таковой. В её рамках изучаются все основные молекулярные процессы жизнедеятельности организма.
1. Метаболические цепи - процессы последовательных превращений исходного вещества, приводящие к образованию некоторого продукта. Все метаболические пути можно подразделить на анаболические и катаболические. Метаболическая цепь, состоящая из реакций, протекающих внутри одной системы, называется внутренней. Метаболическая цепь, реакции которой протекают в разных системах, называется межсистемной. Одно и то же вещество может участвовать в различных превращениях. В подобных случаях наблюдается пересечение различных метаболических цепей. Следствием такого пересечения является возникновение метаболической сети биологической системы. Понимание функционирования одного звена цепи позволяет проводить корректировку нарушений протекания определенного биохимического процесса в организме.
2. Мембранные процессы – это физико-химические процессы, происходящие на поверхности клеточных мембран. К ним относят: процессы активного транспорта веществ, проведение и передача биопотенциалов, рецепция и др. Изучение природы мембранных процессов позволяет на клеточном уровне понимать характер протекающих процессов жизнедеятельности и их патологию.
3. Система синтеза биополимеров – совокупность ферментативных механизмов, которые обеспечивают воспроизведение специфических для данного организма видов высокомолекулярных соединений. Биополимеры играют важнейшую роль во всех процессах жизнедеятельности организма. Поэтому особенно важно понимать суть процессов их воспроизведения.
4. Молекулярные регуляторные системы - системы, направленные на поддержание гомеостаза. Данная системы включают в себя ряд биохимических процессов. Нарушение хотя бы одного звена в системе поддержания гомеостаза, способно вызвать необратимые изменения, которые могут привести к гибели организма.
4. Уровни структурной организации живого. Биохимия как молекулярный уровень изучения явлений жизни. Биохимия и медицина (медицинская биохимия).
Жизнь имеет следующие уровни организации:
1. Молекулярный уровень - отражает особенности химизма живого вещества, а также механизмы и процессы передачи генной информации
2. Клеточный и субклеточный уровни - отражают особенности специализации клеток, а также внутриклеточные структуры. На этом уровне происходят процессы жизнедеятельности (обмен веществ, питание, дыхание, раздражимость и т. д.)
3. Организменный и органно - тканевый уровни - отражают признаки отдельных особей, их строение, физиологию, поведение, а также строение и функции органов и тканей живых существ
4. Популяционно - видовой уровень - образуется свободно скрещивающимися между собой особями одного и того же вида, совокупность особей одного вида
5. Уровень биогеоценозов - структуры, состоящие из участков Земли с определенным составом живых и неживых компонентов, представляющих единый природный комплекс – экосистему
6. Биосферный - вся совокупность живых организмов Земли вместе с окружающей их природной средой
Молекулярный уровень выступает основой для всей жизнедеятельности любого организма на планете, это уровень функционирования биологических макромолекул - биополимеров: нуклеиновых кислот, белков, полисахаридов, липидов, стероидов. На молекулярном уровне происходят различные процессы жизнедеятельности живых организмов: обмен веществ, превращение энергии, формирование биопотенциалов клетки. С помощью молекулярного уровня осуществляется передача наследственной информации, образуются отдельные органоиды, происходят ферментативные процессы. Понимание химических процессов, происходящих в организме – является одной из ключевых задач биологической химии, поэтому она выступает на молекулярном уровне организации живого.
Биохимия оказывает все более глубокое воздействие на медицину. Так, например, определение активности ферментов играет в настоящее время важную роль в клинической диагностике. Содержание определенных ферментов в сыворотке крови может служить ценным критерием при диагностике недавно перенесенного инфаркта миокарда. Кроме того, биохимия постепенно создает основу для рационального назначения лекарственных препаратов. Исключительную важность представляет выяснение молекулярных механизмов некоторых заболеваний, например серповидно-клеточной анемии или большого числа врожденных нарушений метаболизма, исследованных к настоящему времени. Быстрое развитие биохимии в последние годы позволило исследователям приступить к изучению самых острых, коренных проблем биологии и медицины.
5. Основные разделы и направления в биохимии: биоорганическая химия, динамическая и функциональная биохимия, молекулярная биология.
Биохимия включает в себя:
1) Биоорганическая химия - изучает вещества, лежащие в основе процессов жизнедеятельности, в непосредственной связи с познанием их биологической функции. Основные объекты БОХ — биополимеры, превращения которых составляют химическую сущность биологических процессов, и биорегуляторы, которые химически регулируют обмен веществ. БОХ занимается получением этих веществ в химически чистом состоянии, установлением строения, синтезом, выяснением зависимостей между строением и биологическими свойствами, изучением химических аспектов механизма биологического действия биополимеров, а также природных и синтетических биорегуляторов. Характерная особенность БОХ. — использование всего комплекса химических и физических методов индивидуализации веществ и выяснение их строения.
2) Динамическая биохимия - раздел биохимии, изучающий обмен веществ в организме от момента поступления в него питательных веществ до образования конечных продуктов обмена, механизмы нейтрализации токсических продуктов, выведения их из организма и регуляции скорости соответствующих превращений.
3) Функциональная биохимия - раздел биохимии, изучающий химические превращения, лежащие в основе функций органов, тканей и организма в целом.
4) Молекулярная биология - наука, ставящая своей задачей познание природы явлений жизнедеятельности путём изучения биологических объектов и систем на уровне, приближающемся к молекулярному, а в ряде случаев и достигающем этого предела. Конечной целью при этом является выяснение того, каким образом и в какой мере характерные проявления жизни, такие, как наследственность, воспроизведение себе подобного, биосинтез белков, возбудимость, рост и развитие, хранение и передача информации, превращения энергии, подвижность и т. д., обусловлены структурой, свойствами и взаимодействием молекул биологически важных веществ, в первую очередь двух главных классов высокомолекулярных биополимеров.
6. История изучения белков. Представление о белках как важнейшем классе органических веществ и структурно-функциональном компоненте организма человека.
Белки были выделены в отдельный класс биологических молекул в XVIII веке в результате работ французского химика Антуана Фуркруа и других учёных, в которых было отмечено свойство белков коагулировать (денатурировать) под воздействием нагревания или кислот. В то время были исследованы такие белки, как альбумин («яичный белок»), фибрин (белок из крови) и глютен из зерна пшеницы.
Голландский химик Геррит Мульдер провёл анализ состава белков и выдвинул гипотезу, что практически все белки имеют сходную эмпирическую формулу.
Термин «протеин» для обозначения подобных молекул был предложен в 1838 году шведским химиком Якобом Берцелиусом. Мульдер также определил продукты разрушения белков — аминокислоты и для одной из них (лейцина) с малой долей погрешности определил молекулярную массу — 131 дальтон.
В 1836 Мульдер предложил первую модель химического строения белков. Основываясь на теории радикалов он сформулировал понятие о минимальной структурной единице состава белка, C16H24N4O5, которая была названа «протеин», а теория — «теорией протеина». По мере накопления новых данных о белках теория стала неоднократно подвергаться критике, но до конца 1850-х несмотря на критику ещё считалась общепризнанной.
К концу XIX века было исследовано большинство аминокислот, которые входят в состав белков. В 1894 году немецкий физиолог Альбрехт Коссель выдвинул теорию, согласно которой именно аминокислоты являются основными структурными элементами белков.
В начале XX века немецкий химик Эмиль Фишер экспериментально доказал, что белки состоят из аминокислотных остатков, соединённых пептидными связями. Он же осуществил первый анализ аминокислотной последовательности белка и объяснил явление протеолиза. Сложность выделения чистых белков затрудняла их изучение. Поэтому первые исследования проводились с использованием тех полипептидов, которые могли быть очищены в большом количестве, то есть белков крови, куриных яиц, различных токсинов, а также пищеварительных/метаболических ферментов, выделяемых после забоя скота.
Идея о том, что вторичная структура белков — результат образования водородных связей между аминокислотами, была высказана Уильямом Астбери в 1933 году, но Лайнус Полинг считается первым учёным, который смог успешно предсказать вторичную структуру белков. Позднее Уолтер Каузман, опираясь на работы Кая Линдерстрём-Ланга, внёс весомый вклад в понимание законов образования третичной структуры белков и роли в этом процессе гидрофобных взаимодействий.
В 1949 году Фред Сенгер определил аминокислотную последовательность инсулина, продемонстрировав таким способом, что белки — это линейные полимеры аминокислот, а не их разветвлённые (как у некоторых сахаров) цепи, коллоиды или циклолы.
Первые структуры белков, основанные на дифракции рентгеновских лучей на уровне отдельных атомов были получены в 1960-х годах и с помощью ЯМР в 1980-х годах.
В XXI веке исследование белков перешло на качественно новый уровень, когда исследуются не только индивидуальные очищенные белки, но и одновременное изменение количества и посттрансляционных модификаций большого числа белков отдельных клеток, тканей или организмов.
Белки́ (протеи́ны, полипепти́ды ] ) — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью α-аминокислот. Для живых организмов характерны широкое разнообразие белковых структур и их высокая упорядоченность; последняя существует во времени и пространстве. Удивительная способность живых организмов к воспроизведению себе подобных также связана с белками. Сократимость, движение – непременные атрибуты живых систем – имеют прямое отношение к белковым структурам мышечного аппарата. Наконец, жизнь немыслима без обмена веществ, постоянного обновления составных частей живого организма, т.е. без процессов анаболизма и катаболизма (этого удивительного единства противоположностей живого), в основе которых лежит деятельность каталитически активных белков – ферментов.
Таким образом, белки (белковые вещества) составляют основу и структуры, и функции живых организмов. Подсчитано, что в природе примерно 1010–1012 различных белков, обеспечивающих существование около 106 видов живых организмов различной сложности организации начиная от вирусов и кончая человеком. Каждый организм характеризуется уникальным набором белков. Фенотипические признаки и многообразие функций обусловлены специфичностью объединения этих белков, во многих случаях в виде над- и мультимолекулярных структур, в свою очередь определяющих ультраструктуру клеток и их органелл.
7. Аминокислоты, входящие в состав белков, их строение и свойства. Пептидная связь. Первичная структура белков.
α-Аминокислоты представляют собой производные карбоновых кислот, у которых один водородный атом, у α-углерода, замещен на аминогруппу (—NH2).
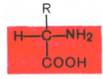
Аминокислоты будут отличаться друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты, связанную с α-углеродным атомом и не участвующую в образовании пептидной связи при синтезе белка. Почти все α-амино- и α-карбоксильные группы участвуют в образовании пептидных связей белковой молекулы, теряя при этом свои специфические для свободных аминокислот кислотно-основные свойства. Поэтому все разнообразие особенностей структуры и функции белковых молекул связано с химической природой и физико-химическими свойствами радикалов аминокислот. Именно благодаря им белки наделены рядом уникальных функций, не свойственных другим биополимерам, и обладают химической индивидуальностью. В состав белков входят 20 природных аминокислот.
Кислотно-основные свойства. Эти свойства аминокислот определяют многие физико-химические и биологические свойства белков. На этих свойствах основаны, кроме того, почти все методы выделения и идентификации аминокислот. Аминокислоты легко растворимы в воде. Они кристаллизуются из нейтральных водных растворов в форме биполярных (амфотерных) ионов, а не в виде недиссоциированных молекул. В связи с этим, они могут проявлять как основные, так и кислотные свойства, что зависит еще от природы входящего в их состав радикала.
Стереохимия аминокислот. Важнейшим свойством аминокислот, освобождающихся в процессе гидролиза природных белков в условиях, исключающих рацемизацию, является их оптическая активность. Это свойство связано с наличием в молекуле всех природных аминокислот (за ислючением глицина) в α-положении асимметрического атома углерода. Стереохимию аминокислот принято оценивать не по оптическому вращению, а исходя из абсолютной конфигурации всех четырех замещающих групп, расположенных вокруг асимметрического атома углерода в вершинах модели тетраэдра. Абсолютную конфигурацию аминокислот принято соотносить стереохимически с соединением, произвольно взятым для сравнения, а именно с глицериновым альдегидом, также содержащим асимметрический атом углерода. Все аминокислоты, образующиеся при гидролизе природных белков в условиях, исключающих рацемизацию, принадлежит к L-ряду. Таким образом, природные аминокислоты имеют пространственное расположение, аналогичное конфигурации L-глицеринового альдегида.
Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты. Из двух аминокислот (1) и (2) образуется дипептид (цепочка из двух аминокислот) и молекула воды. По этой же схеме рибосома генерирует и более длинные цепочки из аминокислот: полипептиды и белки.
Первичная структура — последовательность аминокислот в полипептидной цепи. Важными особенностями первичной структуры являются консервативные мотивы — сочетания аминокислот, играющих ключевую роль в функциях белка. Консервативные мотивы сохраняются в процессе эволюции видов, по ним часто удаётся предсказать функцию неизвестного белка. Первичная структура предопределяет все дальнейшие виды организации белковой молекулы.
8. Зависимость биологических свойств белков от первичной структуры. Видовая специфичность первичной структуры белков (инсулины разных животных).
Анализ данных о первичной структуре белков позволяет сделать следующие общие выводы.
1. Первичная структура белков уникальна и детерминирована генетически. Каждый индивидуальный гомогенный белок характеризуется уникальной последовательностью аминокислот: частота замены аминокислот приводит не только к структурным перестройкам, но и к изменениям физико-химических свойств и биологических функций.
2. Стабильность первичной структуры обеспечивается в основном главновалентными пептидными связями; возможно участие небольшого числа дисульфидных связей.
3. В полипептидной цепи могут быть обнаружены разнообразные комбинации аминокислот; в полипептидах относительно редки повторяющиеся последовательности.
4. В некоторых ферментах, обладающих близкими каталитическими свойствами, встречаются идентичные пептидные структуры, содержащие неизменные (инвариантные) участки и вариабельные последовательности аминокислот, особенно в областях их активных центров. Этот принцип структурного подобия наиболее типичен для ряда протеолитических ферментов: трипсина, химотрипсина и др.
5. В первичной структуре полипептидной цепи детерминированы вторичная, третичная и четвертичная структуры белковой молекулы, определяющие ее общую пространственную конформацию.
Первичная структура инсулина у разных биологических видов несколько различается, как различается и его важность в регуляции обмена углеводов. Наиболее близким к человеческому является инсулин свиньи, который различается с ним всего одним аминокислотным остатком: в 30 положении B-цепи свиного инсулина расположен аланин, а в инсулине человека —треонин; бычий инсулин отличается тремя аминокислотными остатками.
9. Конформация пептидных цепей в белках (вторичная и третичная структуры). Слабые внутримолекулярные взаимодействия в пептидной цепи; дисульфидные связи.
Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями. Ниже приведены самые распространённые типы вторичной структуры белков:
1) α-спирали — плотные витки вокруг длинной оси молекулы, один виток составляют 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм (так что на один аминокислотный остаток приходится 0,15 нм), спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Спираль построена исключительно из одного типа стереоизомеров аминокислот (L). Хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина. Расположенные близко друг к другу остатки аспарагина, серина, треонина и лейцина могут стерически мешать образованию спирали, остатки пролина вызывает изгиб цепи и также нарушает α-спирали.
2) β-листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга (0,347 нм на аминокислотный остаток) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в противоположные стороны (антипараллельная ориентация). Для образования β-листов важны небольшие размеры боковых групп аминокислот, преобладают обычно глицин и аланин.
Стабильность вторичной структуры обеспечивается в основном водородными связями (определенный вклад вносят и главновалентные связи – пептидные и дисульфидные). Водородная связь представляет собой слабое электростатическое притяжение (взаимодействие, связь) между одним электроотрицательным атомом (например, кислородом или азотом) и водородным атомом, ковалентно связанным со вторым электроотрицательным атомом. По современным представлениям, водородная связь включает не только электростатические силы притяжения между полярными группами. но и электронные связи такого же типа, как в ряде комплексных соединений. Водородные связи, являясь нековалентными, отличаются малой прочностью. Поскольку в белковой молекуле число водородных связей очень велико (в образование водородных связей вовлечены все пептидные группы), они в сумме обеспечивают скручивание полипептидной цепи в спиральную структуру, сообщая ей компактность и стабильность.
Третичная или трёхмерная структура — пространственное строение полипептидной цепи (набор пространственных координат составляющих белок атомов). Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. В стабилизации третичной структуры принимают участие:
1) диcульфи́дная связь — ковалентная связь между двумя атомами серы, входящими в состав серусодержащей аминокислоты цистеина. Образующие дисульфидную связь аминокислоты могут находиться как в одной, так и в разных полипептидных цепях белка. Дисульфидные связи образуются в процессе посттрансляционной модификации белков и служат для поддержания третичной и четвертичной структур белка;
2) ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
3) водородные связи;
4) гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
10.Основы функционирования белков. Активный центр белков и его специфическое взаимодействие с лигандом как основа биологической функции всех белков. Комплементарность взаимодействия молекул белка с лигандом. Обратимость связывания.
Каждый индивидуальный белок, имеющий уникальную первичную структуру и конформацию, обладает и уникальной функцией, отличающей его от остальных белков. Набор индивидуальных белков выполняет в клетке множество разнообразных и сложных функций. Необходимое условие для функционирования белков - присоединение к нему другого вещества, которое называют " лиганд ". Лигандами могут быть как низкомолекулярные вещества, так и макромолекулы. Взаимодействие белка с лигандом высокоспецифично и обратимо, что определяется строением участка белка, называемого центром связывания белка с лигандом или активным центром.
Активный центр белков - определённый участок белковой молекулы, как правило, находящийся в её углублении ("кармане"), сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга.Уникальные свойства активного центра зависят не только от химических свойств формирующих его аминокислот, но и от их точной взаимной ориентации в пространстве. Поэтому даже незначительные нарушения общей конформации белка в результате точечных изменений его первичной структуры или условий окружающей среды могут привести к изменению химических и функциональных свойств радикалов, формирующих активный центр, нарушать связывание белка с лигандом и его функцию. При денатурации активный центр белков разрушается, и происходит утрата их биологической активности.
Под комплементарностью понимают пространственное и химическое соответствие взаимодействующих молекул. Лиганд должен обладать способностью входить и пространственно совпадать с конформацией активного центра. Это совпадение может быть неполным, но благодаря конформационной лабильности белка активный центр способен к небольшим изменениям и "подгоняется" под лиганд. Кроме того, между функциональными группами лиганда и радикалами аминокислот, образующих активный центр, должны возникать связи, удерживающие лиганд в активном центре. Связи между лигандом и активным центром белка могут быть как нековалентными (ионными, водородными, гидрофобными), так и ковалентными.
11. Доменная структура и её роль в функционировании белков. Яды и лекарства как ингибиторы белков.
Доме́н белка́ — элемент третичной структуры белка, представляющий собой достаточно стабильную и независимую подструктуру белка, чей фолдинг проходит независимо от остальных частей. В состав домена обычно входит несколько элементов вторичной структуры. Сходные по структуре домены встречаются не только в родственных белках (например, в гемоглобинах разных животных), но и в совершенно разных белках. Домены могут выполнять разные функции и подвергаться складыванию (свертыванию) в независимые компактные глобулярные структурные единицы, соединенные между собой гибкими участками внутри белковой молекулы.
Достаточно часто доменам присваивают отдельные названия, так как их присутствие непосредственно влияет на выполняемые белком биологической функции, к примеру, Ca2+-связывающий домен кальмодулина, гомеодомен, отвечающий за связывание с ДНК в различных факторах транскрипции. Разные домены в белке могут перемещаться друг относительно друга при взаимодействии с лигандом, что облегчает дальнейшее функционирование белка.
Аналоги естественных лигандов белков используют в медицине в качестве лекарственных средств. Широкое применение такие лекарства нашли в регуляции передачи возбуждения через синапсы. Нейромедиатор, выделяемый при прохождении импульса нервными окончаниями, должен высокоспецифично взаимодействовать с белками-рецепторами на постсинаптической мембране. Однако, модифицируя химическую структуру нейромедиатора, можно получить вещества, которые также связывались бы с рецептором, но при этом менялся физиологический эффект: уменьшался или усиливался. В фармакологии такие вещества называют "антагонисты" и "агонисты" соответственно.
Однако некоторые структурные аналоги ли-гандов рецепторных белков не являются ингибиторами, а вызывают такие же или более сильные физиологические эффекты, чем природные лиганды. Их более сильный и длительный эффект часто связан с тем, что модифицированные лиганды медленнее инактивируются и разрушаются в организме.
Некоторые яды, попадая в организм человека, прочно связываются с определёнными белками, ингибируют их и тем самым вызывают нарушения биологических функций. Например, нейротоксины кобры и крайта специфически взаимодействуют с холинергическими рецепторами постсинаптических мембран, блокируя их работу, и оказывают курареподобное действие. Сродство нейротоксинов к холинергическим рецепторам очень высоко между токсином рецептором образуется множество связей, что и приводит к их практически необратимому соединению.
Необходимо помнить, что между лекарствами и ядами часто существует прозрачная граница, и эффект их действия зависит от дозы вводимого вещества. Так, лекарства, назначаемые в дозах, больших чем терапевтические, могут действовать как яды, т.е. вызывать серьёзные нарушения обмена веществ и функций организма, а яды в микродозах часто используют как лекарственные препараты. Например, атропин, широко применяемый для снятия спазмов гладких мышц, в больших дозах вызывает возбуждение ЦНС, а в ещё больших дозах - сон, переходящий в кому. Известное гапотензивное средство клофелин при передозировке вызывает коллапс.
12.Четвертичная структура белков. Особенности строения и функционирования олигомерных белков на примере гемсодержащего белка - гемоглобина.
Четверичная структура (или субъединичная, доменная) —способ укладки в пространстве отдельных полипептидных цепей, обладающих одинаковой (или разной) первичной, вторичной или третичной структурой, и формирование единого в структурном и функциональном отношениях макромолекулярно-го образования. Многие функциональные белки состоят из нескольких полипептидных цепей, соединенных не главновалентными связями, а неко-валентными (аналогичными тем, которые обеспечивают стабильность третичной структуры). Каждая отдельно взятая полипептидная цепь, получившая название протомера, мономера или субъединицы, чаще всего не обладает биологической активностью. Эту способность белок приобретает при определенном способе пространственного объединения входящих в его состав протомеров, т.е. возникает новое качество, не свойственное мономерному белку. Образовавшуюся молекулу принято называть олигомером (или мультимером). Олигомерные белки чаще построены из четного числа протомеров (от 2 до 4, реже от 6 до 8) с одинаковыми или разными молекулярными массами – от нескольких тысяч до сотен тысяч. В частности, молекула гемоглобина состоит из двух одинаковых α- и двух β-полипептидных цепей, т.е. представляет собой тетрамер. Молекула гемоглобина содержит четыре полипептидные цепи, каждая из которых окружает группу гема – пигмента, придающего крови ее характерный красный цвет. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков. Простетическая группа нековалентно связана с гидрофобной впадиной молекулы гемоглобина
13.Лабильность пространственной структуры белков и их денатурация. Факторы, вызывающие денатурацию.
Под лабильностью пространственной структуры белка понимают способность структуры белковой молекулы претерпевать конформационные изменения под действием различных физико-химических факторов.
Под денатурацией следует понимать нарушение общего плана уникальной структуры нативной молекулы белка, преимущественно ее третичной структуры, приводящее к потере характерных для нее свойств (растворимость, электрофоретическая подвижность, биологическая активность и т.д.) Внешние проявления денатурации сводятся к потере растворимости, особенно в изоэлектрической точке, повышению вязкости белковых растворов, увеличению количества свободных функциональных SH-групп и изменению характера рассеивания рентгеновских лучей. Наиболее характерным признаком денатурации является резкое снижение или полная потеря белком его биологической активности (каталитической, антигенной или гормональной). При непродолжительном действии и быстром удалении денатурирующих агентов возможна ренатурация белка с полным восстановлением исходной трехмерной структуры и нативных свойств его молекулы, включая биологическую активность. Таким образом, при денатурации белковая молекула полностью теряет биологические свойства, демонстрируя тем самым тесную связь между структурой и функцией.
14.Шапероны - класс белков, защищающий другие белки от денатурации в условиях клетки и облегчающий формирование их нативной конформации.
Шаперо́ны (англ. chaperones) — класс белков, главная функция которых состоит в восстановлении правильной третичной структуры повреждённых белков, а также образование и диссоциация белковых комплексов. Термин «молекулярный шаперон» впервые был использован в работе Ласкей и других при описании ядерного белка нуклеоплазмина, способного предотвращатьагрегирование белков-гистонов с ДНК при образовании нуклеосом. Шапероны есть во всех живых организмах, и механизм их действия, нековалентное присоединение к белкам и их «расплетение» с использованием энергии гидролиза АТФ также консервативен.
Многие шапероны являются белками теплового шока, то есть белками, экспрессия которых начинается в ответ на рост температуры или другие клеточные стрессы. Тепло сильно влияет на фолдинг белка, а некоторые шапероны участвуют в исправлении потенциального вреда, который возникает из-за неправильного сворачивания белков.
Другие шапероны участвуют в фолдинге только что созданных белков в тот момент, когда они «вытягиваются» из рибосомы. И хотя большинство только что синтезированных белков могут сворачиваться и при отсутствии шаперонов, некоторому меньшинству обязательно требуется их присутствие.
Другие типы шаперонов участвуют в транспортировке веществ сквозь мембраны, например в митохондриях иэндоплазматическом ретикулуме у эукариот.
Продолжают обнаруживаться новые функции шаперонов, например, участие в разрушении белка, деятельности бактериального адгезина и в реакциях на заболевания, связанные с агрегацией белков.
15.Многообразие белков. Глобулярные и фибриллярные белки, простые и сложные. Классификация белков по их биологическим функциям и по семействам: (сериновые протеазы, иммуноглобулины).
До настоящего времен нет единой и стройной классификации, учитывающей различные параметры белков. В основе имеющихся классификаций обычно лежит один признак. Так, белки можно классифицировать:
1. по форме молекул (глобулярные или фибриллярные);
2. по молекулярной массе (низкомолекулярные, высокомолекулярные и др.);
3. по химическому строению (наличие или отсутствие небелковой части);
4. по выполняемым функциям (транспортные, защитные, структурные белки и др.);
5. по локализации в клетке (ядерные, цитоплазматические, лизосомальные и др.);
6. по локализации в организме (белки крови, печени, сердца и др.);
7. по возможности адаптивно регулировать количество данных белков: белки, синтезирующиеся с постоянной скоростью (конститутивные), и белки, синтез которых может усиливаться при воздействии факторов среды (индуцибельные);
8. по продолжительности жизни в клетке (от очень быстро обновляющихся белков, с Т1/2 менее 1 ч, до очень медленно обновляющихся белков, Т1/2 которых исчисляют неделями и месяцами);
9. по схожим участкам первичной структуры и родственным функциям (семейства белков).
Одной из самых старых и распространенных классификаций белков является классификация по форме молекулы.
Она делит белки на 2 группы: глобулярные и фибриллярные. К глобулярным относят белки, соотношение продольной и поперечной осей которых не превышает 1:10, а чаще составляет 1:3 или 1:4, т.е. белковая молекула имеет форму эллипса. Большинство индивидуальных белков человека относят к глобулярным белкам. Они имеют компактную структуру и многие из них, за счёт удаления гидрофобных радикалов внутрь молекулы, хорошо растворимы в воде.
Фибриллярные белки имеют вытянутую, нитевидную структуру, в которой соотношение продольной и поперечной осей составляет более 1:10. К фибриллярным белкам относят коллагены, эластин, кератин, выполняющие в организме человека структурную функцию, а также миозин, участвующий в мышечном сокращении, и фибрин - белок свёртывающей системы крови.
По химическому строению белки делят на простые и сложные. Белки, содержащие в своём составе только полипептидные цепи, состоящие из аминокислотных остатков, называют простые белки. Примером простых белков могут служить основные белки хроматина - гистоны; в их составе содержится много аминокислотных остатков лизина и аргинина, радикалы которых имеют положительный заряд. Однако очень многие белки, кроме полипептидных цепей, содержат в своём составе небелковую часть, присоединённую к белку слабыми или ковалентными связями. Небелковая часть может быть представлена ионами металлов, какими-либо органическими молекулами с низкой или высокой молекулярной массой. Такие белки называют сложные белки. Прочно связанная с белком небелковая часть носит название простетической группы. Простетическая группа может быть представлена веществами разной природы. Например, белки, соединённые с гемом, носят название гемопротеины.
Белки, соединённые с остатком фосфорной кислоты, называют фосфопротеинами. Фосфорные остатки присоединяются сложноэфирной связью к гидроксильным группам серина, треонина или тирозина при участии ферментов, называемых протеинкиназами.
В состав белков часто входят углеводные остатки, придающие белкам дополнительную специфичность и часто уменьшающие скорость их ферментативного протеолиза. Такие белки носят название гликопротеинов. Многие белки крови, а также рецепторные белки клеточной поверхности относят к гликопротеинам.
Белки, функционирующие в комплексе с липидами, называют липопротеинами, а в комплексе с металлами - металлопротеинами.
Сложный белок, состоящий из белковой части (апопротеин) и небелковой части (простетическая группа), называют " холопротеин ".
В ходе эволюции в пределах одного биологического вида замены аминокислотных остатков могут приводить к возникновению разных белков, выполняющих родственные функции и имеющих гомологичные последовательности аминокислот. Такие белки, имеющие гомологичные участки полипептидной цепи, сходную конформацию и родственные функции, выделяют в семейства белков
К семейству родственных белков относят сериновые протеазы. Это семейство ферментов, которые используют уникально активированный остаток серина, расположенный в активном центре, для связывания и каталитического гидролиза пептидных связей в белковых субстратах. Мишени для сериновых протеаз - специфические пептидные связи в белках (часто в других сериновых протеазах). Д ля всех белков этого семейства характерно наличие в активном центре остатков Сер195, Гис57, Асп102 (эту нумерацию используют независимо от их точного расположения в первичной структуре определённых сериновых протеаз). Выявлена также высокая схожесть их пространственных структур, несмотря на то, что только в 40% положений они содержат идентичные аминокислоты. Каталитический участок сериновых протеаз расположен в расщелине между двумя доменами. Некоторые аминокислотные замены привели к изменению субстратной специфичности этих белков и к возникновению функционального многообразия внутри этого семейства. Так, пищеварительные сериновые протеазы участвуют в переваривании (гидролитическом расщеплении пептидных связей) денатурированных пищевых белков. К ним относят трипсин, химотрипсин, эластазу, но каждый из этих ферментов предпочитает разрывать пептидные связи, образованные определёнными аминокислотами. Ещё большей субстратной специфичностью обладают сериновые протеазы, участвующие в тщательно контролируемых физиологических процессах, таких как активация каскада белков свёртывания крови, фибринолиза, активация белков системы комплемента, образования белковых гормонов.
Иммуноглобулины, или антитела, - специфические белки, вырабатываемые В-лимфоцитами в ответ на попадание в организм чужеродных структур, называемых антигенами. В организме человека вырабатывается около 107 клонов В-лимфоцитов, каждый из которых специализирован на выработке одного из 107 видов иммуноглобулинов. Все иммуноглобулины характеризуются общим планом строения: состоят из четырёх полипептидных цепей: двух идентичных лёгких (L - от англ,light), содержащих около 220 аминокислотных остатков, и двух тяжёлых (Н - от англ. heavy), состоящих из 440 аминокислот каждая. Все 4 цепи соединены друг с другом множеством нековалентных и четырьмя дисульфидными связями. Лёгкие цепи состоят из 2 доменов: вариабельного (VL), находящегося в N-концевой области полипептидной цепи, и константного (CL), расположенного на С-конце. Каждый из доменов состоит из 2 слоев с β-складчатой структурой, где участки полипептидной цепи лежат антипараллельно. β-Слои связаны ковалентно дисульфидной связью примерно в середине домена. Т яжёлые цепи имеют 4 домена: один вариабельный (VH), находящийся на N-конце, и три константных (СН1, СН2, СH3). Домены тяжёлых цепей IgG имеют гомологичное строение с доменами лёгких цепей. Между двумя константными доменами тяжёлых цепей СH1, и СН2 есть участок, содержащий большое количество остатков пролина, которые препятствуют формированию вторичной структуры и взаимодействию соседних Н-цепей на этом отрезке. Этот участок называют "шарнирной областью"; он придаёт молекуле гибкость. Между вариабельными доменами тяжёлых и лёгких цепей находятся два идентичных участка, связывающих два одинаковых специфических антигена; поэтому такие антитела часто называют " биваленты ". Основные функции антител - обнаружение и связывание чужеродных антигенов, находящихся в организме вне его клеток (в крови, лимфе, межклеточной жидкости, в слизистых секретах). Это происходит с помощью специфических антигенсвязывающих участков разных клонов иммуноглобулинов. Кроме, того, благодаря связыванию антигена с антителом облегчается процесс дальнейшего разрушения чужеродных веществ. Специфичность пути разрушения комплекса антиген-антитело зависит от класса антител, которых существует 5 типов: IgA, IgD, IgE, IgG, IgM.
16.Иммуноглобулины, особенности строения, избирательность взаимодействия с антигеном. Многообразие антигенсвязывающих участков Н- и L-цепей. Классы иммуноглобулинов, особенности строения и функционирования
Иммуноглобулины, или антитела, - специфические белки, вырабатываемые В-лимфоцитами в ответ на попадание в организм чужеродных структур, называемых антигенами. В организме человека вырабатывается около 107 клонов В-лимфоцитов, каждый из которых специализирован на выработке одного из 107 видов иммуноглобулинов. Все иммуноглобулины характеризуются общим планом строения: состоят из четырёх полипептидных цепей: двух идентичных лёгких (L - от англ,light), содержащих около 220 аминокислотных остатков, и двух тяжёлых (Н - от англ. heavy), состоящих из 440 аминокислот каждая. Все 4 цепи соединены друг с другом множеством нековалентных и четырьмя дисульфидными связями. Лёгкие цепи состоят из 2 доменов: вариабельного (VL), находящегося в N-концевой области полипептидной цепи, и константного (CL), расположенного на С-конце. Каждый из доменов состоит из 2 слоев с β-складчатой структурой, где участки полипептидной цепи лежат антипараллельно. β-Слои связаны ковалентно дисульфидной связью примерно в середине домена. Т яжёлые цепи имеют 4 домена: один вариабельный (VH), находящийся на N-конце, и три константных (СН1, СН2, СH3). Домены тяжёлых цепей IgG имеют гомологичное строение с доменами лёгких цепей. Между двумя константными доменами тяжёлых цепей СH1, и СН2 есть участок, содержащий большое количество остатков пролина, которые препятствуют формированию вторичной структуры и взаимодействию соседних Н-цепей на этом отрезке. Этот участок называют "шарнирной областью"; он придаёт молекуле гибкость. Между вариабельными доменами тяжёлых и лёгких цепей находятся два идентичных участка, связывающих два одинаковых специфических антигена; поэтому такие антитела часто называют " биваленты ". Основные функции антител - обнаружение и связывание чужеродных антигенов, находящихся в организме вне его клеток (в крови, лимфе, межклеточной жидкости, в слизистых секретах). Это происходит с помощью специфических антигенсвязывающих участков разных клонов иммуноглобулинов. Кроме, того, благодаря связыванию антигена с антителом облегчается процесс дальнейшего разрушения чужеродных веществ. Специфичность пути разрушения комплекса антиген-антитело зависит от класса антител, которых существует 5 типов: IgA, IgD, IgE, IgG, IgM.
Иммуноглобулины М - первый класс антител, синтезирующийся в развивающихся В-лимфоцитах. Различают 2 формы иммуноглобулинов М: мономерная, мембранно-связанная форма и пентамерная, секретируемая В-лимфоцитами в кровь.
Мембранно-с вязанная форма иммуноглобулинов М. Созревающие В-лимфоциты синтезируют мономерные бивалентные молекулы IgM, по структуре похожие на рассматриваемые выше IgG, которые встраиваются в плазматическую мембрану клеток и играют роль первых антиген-распознающих рецепторов. Прикрепление IgM к мембране осуществляется с помощью гидрофобного участка, находящегося в С-концевой ("хвостовой") области тяжёлых цепей, содержащей 25 гидрофобных аминокислотных остатков. Взаимодействие антигена с рецептором на поверхности В-лимфоцита вызывает его размножение и образование целого клона лимфоцитов, происходящих из одной, стимулированной антигеном клетки. Этот клон В-лимфоцитов будет вырабатывать иммуноглобулины с одинаковыми антигенсвязывающими участками. Однако В-лимфоциты способны переключаться на выработку других классов антител.
Секреторная форма иммуноглобулинов М. Когда В-лимфоциты впервые встречаются в жидкостях организма с неизвестным ранее антигеном, они синтезируют и секретируют в кровь IgM, которые содержат пять мономерных субъединиц, связанных друг с другом дисульфидными связями и дополнительной полипептидной J-цепью (рис. 1-46).
В тяжёлых цепях их мономеров отсутствует гидрофобная "хвостовая" часть. Пентамерная молекула содержит 10 участков связывания с антигеном, что облегчает вероятность прикрепления Неизвестного ранее антигена к иммуноглобулину. Взаимодействие антигена с IgM изменяет его конформацию и индуцирует связывание его "хвостовой" области с первым компонентом системы комплемента. Если антиген расположен на поверхности микроорганизма, активирование системы комплемента вызывает нарушение целостности клеточной мембраны и гибель бактериальной клетки.
Иммуноглобулины G. В количественном отношении IgG доминируют в крови и составляют около 75% от общего количества этих белков. Строение IgG подробно описано выше. В крови IgG обнаруживают только в мономерной форме; он секретируется активированными В-лимфоцитами в больших количествах при вторичном иммунном ответе, когда антиген повторно попадает в организм. У человека обнаружено 4 подкласса IgG: IgGg1, IgGg2, IgGg3, IgGg4. Порядковый номер указывает на количественное содержание каждого подкласса в сыворотке (в наибольшем количестве содержится IgGg1 а в наименьшем - gGg4). Степень гомологии между этими подклассами очень высока (около 90-95%). IgG не только эффективно связывают и инактивируют чужеродные молекулы и клетки, попавшие в организм, но также облегчают их дальнейшее уничтожение. Конформационные изменения в "хвостовой" области IgG после его взаимодействия с антигеном приводят к связыванию и активации белков системы комплемента. Кроме того, С-концевая область IgG способна взаимодействовать со специфическими рецепторами макрофагов и нейтрофилов, что приводит к фагоцитозу комплексов антиген-антитело и разрушению их в фагосомах. IgG - единственный класс антител, способный проникать через плацентарный барьер и обеспечивать внутриутробную защиту плода от инфекций.
Иммуноглобулины А. Основной класс антител, присутствующий в секретах желёз организма (слюны, молока, пищеварительного сока, секретов дыхательных путей). В сыворотке крови его содержание не превышает 10-15% от общего количества иммуноглобулинов. Мономерная форма по строению напоминает IgG. Однако в секретах IgA находится в основном в форме димера, где мономеры соединены дополнительной пептидной цепью J. На базальной поверхности эпителиальных клеток димер IgA специфически взаимодействует с белками клеточной поверхности, называемыми секреторным компонентом. Образующийся комплекс посредством эндоцитоза поглощается внутрь клетки и перемещается к апикальной части. Здесь комплекс подвергается действию протеолитических ферментов, и свободный димер высвобождается во внеклеточное пространство. Образующийся при взаимодействии IgA с антигеном комплекс не взаимодействует с белками системы комплемента и фагоцитирующими клетками, но препятствует прикреплению антигенов к поверхности эпителиальных клеток и проникновению их в организм.
Иммуноглобулины Е. Содержание этого класса иммуноглобулинов в крови крайне мало. IgE - мономеры, но, в отличие от IgG, их тяжёлые цепи е содержат не 3, а 4 константных домена. После синтеза и секреции в кровь В-лимфоцитами IgE связываются своими С-концевыми участками с соответствующими рецепторами на поверхности тучных клеток и базофилов. В результате они становятся рецепторами антигенов на поверхности данных клеток. После присоединения антигена хотя бы к двум антигенсвязывающим участкам двух соседних IgE клетка получает сигнал к секреции биологически активных веществ (серотонина, гистамина), хранящихся в секреторных пузырьках. Выброс этих веществ в значительной мере ответственен за развитие воспалительной реакции, а также таких аллергических реакций, как бронхиальная астма, крапивница, сенная лихорадка. Увеличение количества IgE может предшествовать развитию аллергических реакций.
Иммуноглобулины D. IgD обнаружены в крови в очень малых количествах. Мономерные белки играют роль рецепторов В-лимфоцитов; других функций у IgD пока не выявлено.
17.Физико-химические свойства белков. Молекулярный вес, размеры и форма, растворимость, ионизация, гидратация
Индивидуальные белки различаются по своим физико-химическим свойствам: форме молекул, молекулярной массе, суммарному заряду молекулы, соотношению полярных и неполярных групп на поверхности нативной молекулы белка, растворимости белков, а также степени устойчивости к воздействию денатурирующих агентов.
Различия белков по молекулярной массе. Б елки - высокомолекулярные соединения, но могут сильно отличаться по молекулярной массе, которая колеблется от 6000 до 1 000 000 Да и выше. Молекулярная масса белка зависит от количества аминокислотных остатков в полипептидной цепи, а для олигомерных белков - и от количества входящих в него протомеров (или субъединиц).
Различия белков по форме молекул. П о форме молекул белки делят на глобулярные и фибриллярные. Глобулярные белки имеют более компактную структуру, их гидрофобные радикалы в большинстве своём спрятаны в гидрофобное ядро, и они значительно лучше растворимы в жидкостях организма, чем фибриллярные белки (исключение составляют мембранные белки).
Различия по р астворимости белков. Растворимость белков в воде зависит от формы, молекулярной массы, величины заряда, соотношения полярных и неполярных функциональных групп на поверхности белка. Кроме этого, растворимость белка определяется составом растворителя, т.е. наличием в растворе других растворённых веществ. Например, некоторые белки легче растворяются в слабом солевом растворе, чем в дистиллированной воде. С другой стороны, увеличение концентрации нейтральных солей может способствовать выпадению определённых белков в осадок. Денатурирующие агенты, присутствующие в растворе, также снижают растворимость белков.
Различия по гидратации. На поверхности большинства внутриклеточных белков преобладают полярные радикалы, однако соотношение полярных и неполярных групп отлично для разных индивидуальных белков. Так, протомеры олигомерных белков в области контактов друг с другом часто содержат гидрофобные радикалы. Поверхности белков, функционирующих в составе мембран или прикрепляющиеся к ним в процессе функционирования, также обогащены гидрофобными радикалами. Такие белки лучше растворимы в липидах, чем в воде.
Различия по ионизации. Белки имеют в своём составе радикалы лизина, аргинина, гистидина, глутаминовой и аспарагиновой кислот, содержащие функциональные группы, способные к ионизации (ионогенные группы). Кроме того, на N- и С-концах полипептидных цепей имеются α-амино- и α-карбоксильная группы, также способные к ионизации. Суммарный заряд белковой молекулы зависит от соотношения ионизированных анионных радикалов Глу и Асп и катионных радикалов Лиз, Apг и Гис. Значение рН, при котором белок приобретает суммарный нулевой заряд, называют " изоэлектрическая точка " и обозначают как pI. В изоэлектрической точке количество положительно и отрицательно заряженных групп белка одинаково, т.е. белок находится в изоэлектрическом состоянии. Так как большинство белков в клетке имеет в своём составе больше анионогенных групп (-СОО-), то изоэлектрическая точка этих белков лежит в слабокислой среде. Изоэлектрическая точка белков, в составе которых преобладают катионогенные группы, находится в щелочной среде. Наиболее яркий пример таких внутриклеточных белков, содержащих много аргинина и лизина, - гистоны, входящие в состав хроматина. Белки, имеющие суммарный положител
 2015-04-12
2015-04-12 1929
1929
