ТЕМА: Моль. Эквиваленты и эквивалентные массы простых и сложных веществ. Закон эквивалентов
Международная система единиц измерения (СИ) состоит из шести основных единиц: метр (м) — длина, килограмм (Кг) — масса, секунда (с) — время, ампер (А) — сила тока, Кельвин (К) — термодинамическая температура, кандела (кд) — сила света.
В качестве седьмой основной единицы Международной системы является моль — единицу количества вещества. Моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг. При применении моля структурные элементы должны быть специфицированы и могут быть атомами, молекулами, ионами, электронами и другими частицами или специфицированными группами частиц. Моль вещества соответствует постоянной Авогадро NA = 6,02223 моль-1 структурных элементов. При применении понятия "моль" следует указывать, какие структурные элементы имеются в виду, например, моль атомов Н, моль молекул Н2, моль протонов, моль электронов и т.п. Так, заряд моля электронов равен 6,022·1023 ē и отвечает количеству электричества, равному 1 фараде (F). Масса моля атомов или масса моля молекул называется мольная или молярная масса и выражена в г/моль.
Пример 1. Выразите в молях: а) 6,02·1021 молекул СО2; б) 1,20·1024 атомов кислорода; в) 2,00·1023 молекул воды. Чему равна мольная (молярная) масса указанных веществ?
Решение. Моль — это количество вещества, в котором содержится число частиц любого определенного сорта, равное постоянной Авогадро (6,02·1023). Отсюда а) 6,02·1021, т.е. 0,01 моль; б) 1,20·1024, т.е. 2 моль; в) 2,00·1023, т.е. 1 /З моль.
Масса моля вещества выражается в г/моль. Мольная (молярная) масса вещества в граммах численно равна его относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а.е.м).
Так как молекулярные массы СО2 и Н2О и атомная масса кислорода соответственно равны 44, 18 и 16 а.е.м., то их мольные (молярные) массы равны:
а) 44 г/моль; б) 18г/моль; в) 16 г/моль.
Пример 2. Определите эквивалент (Э) и эквивалентную массу МЭ азота, серы и хлора в соединениях NН3, Н2S и НСl.
Решение. Масса вещества и количество вещества — понятия неидентичные. Масса выражается в килограммах (граммах), а количество вещества — в молях.
Эквивалент элемента (Э) — это такое количество вещества, которое соединяется с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях. Масса 1 эквивалента элемента называется его эквивалентной массой (МЭ). Таким образом, эквиваленты выражаются в молях, а эквивалентные массы — в г/моль.
В данных соединениях с 1 моль атомов водорода соединяется 1/3 моль азота, 1/2 моль серы и 1 моль хлора. Отсюда Э(N) = 1/3 моль, Э(S) =1/2 моль, Э(Сl) = 1 моль. Исходя из мольных масс этих элементов, определяем их эквивалентные массы: МЭ(N) = 1/3·14= 4,67 г/моль; МЭ(S) =1/2·32= 16г/моль; МЭ(Cl) = 1·35.45 =35,45 г/моль.
Пример 3. На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода (н.у.). Вычислите эквивалентную массу оксида и эквивалентную массу металла. Чему равна атомная масса металла?
Нормальные условия по Международной системе единиц (СИ): давление 1,013·105 Па (760 мм рт. ст., 1 атм), температура 273 К или 0°С.
Решение. Согласно закону эквивалентов массы (объемы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объемам):
m1/Мэ(1) = m2/Мэ(2) (1)
m(МеО)/Мэ(МеО) = m(Н2)/Мэ(Н2) (2)
Если одно из веществ находится в газообразном состоянии, то, как правило, его количество измеряется в объемных единицах (мл, л, м 3).
Объем, занимаемый при данных условиях мольной или эквивалентной массой газообразного вещества, называется мольным или, соответственно, эквивалентным объемом этого вещества. Мольный объем любого газа при н.у. равен 22,4 л. Отсюда эквивалентный объем водорода (Vэ) молекула которого состоит из двух атомов, т.е. содержит два моля атомов водорода, равен 22,4:2 = 11,2 л. В формуле (2) отношение mH2 ⁄ МЭ(Н2) заменяем равным ему отношением VH2 ⁄ VЭ(Н2), где VH2 - объем водорода, VЭ(Н2) эквивалентный объем водорода:
m(МеО)/Мэ(МеО) = V(Н2)/Vэ(Н2) (3)
Из уравнения (3) находим эквивалентную массу оксида металла МЭ(МеО)
7,09/МЭ(МеО) = 2,24/11,2; МЭ(МеО) = 7,09·11,2/2,24 = 35,45 г/моль.
Согласно закону эквивалентов МЭ(МeO) = МЭ(Мe) + МЭ(O2),
отсюда МЭ(Мe) = МЭ(МeО) - МЭ(O2) = 35,45 – 8 = 27,45 г/моль.
Мольная масса металла определяется из соотношения:
МЭ = А/В,
Где: МЭ - эквивалентная масса, г/моль
А — мольная масса металла, г/моль
В — валентность элемента;
А = Мэ·В = 27,45∙2 = 54,9 г/моль.
Так как атомная масса в а.е.м. численно равна мольной (молярной) массе, выражаемой в г/моль, то искомая атомная масса металла 54,9 а.е.м.
Пример 4, Сколько граммов металла, эквивалентная масса которого 12,16 г/моль, взаимодействует с 310 см3 кислорода (н.у.)?
Решение. Так как мольная (молярная) масса 02 (32 г/моль) при н.у. занимает объем 22,4 л, то объем эквивалентной массы кислорода (8 г/моль) будет 22,4: 4=5,6 л. =5600 см3. По закону эквивалентов

Пример 5. Вычислите эквиваленты и эквивалентные массы Н2SO4 и А1(ОН)3 в реакциях, выраженных уравнениями:

Решение. Эквивалент (эквивалентная масса) сложного вещества, как и эквивалент (эквивалентная масса) элемента, может иметь различные значения и зависит от того, в какую реакцию обмена вступает это вещество. Эквивалентная масса кислоты (основания) равна мольной массе (М), деленной на число атомов водорода, замещенных в данной реакции на металл (на число вступающих в реакцию гидроксильных групп). Следовательно, эквивалентная масса H2SO4 реакции (1) MH2SO4= 98 г⁄моль, в реакции (2) MH2SO4 ⁄ 2 = 49 г/моль. Эквивалентная масса А1(ОН)3 в реакции (3) МА1(ОН)3 = 78 г/моль, а в реакции (4) МА1(ОН)3 ⁄ 3 = 26 г/моль.
Задачу можно решить и другим способом. Так как H2SO4 взаимодействует с одной эквивалентной массой КОН и двумя эквивалентными массами магния, то ее эквивалентная масса равна в реакции (1) М / l г/моль и в реакции (2) M ⁄ 2 г/моль. А1(ОН)3 взаимодействует с одной эквивалентной массой НС1 и тремя эквивалентными массами НNО3, поэтому его эквивалентная масса в реакции (3) равна М ⁄ 1 г/моль, в реакции (4) М / 3 г/моль. Эквиваленты H2SO4 в уравнениях (1) и (2) соответственно равны 1 моль и 1/2 моль; эквиваленты А1(ОН)3 в уравнениях (3) и (4) соответственно равны 1 моль и 1/3 моль.
Пример 6. Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислите эквивалентную массу металла (МЭ(Ме)).
Решение. При решении задачи следует иметь в виду: а) эквивалент (эквивалентная масса) гидроксида равен сумме эквивалентов (эквивалентных масс) металла и гидроксильной группы; б) эквивалент (эквивалентная масса) соли равен сумме эквивалентов (эквивалентных масс) металла и кислотного остатка. Вообще эквивалент (эквивалентная масса) химического соединения равен сумме эквивалентов (эквивалентных масс) составляющих его частей.
Учитывая сказанное, подставляем соответствующие данные в уравнение (1) примера 3:
3,85/1,60 = (Мэ(Ме) + Мэ(NО3-)) / (Мэ(Ме) + Мэ(ОН-));
3,85/1,60 = (Мэ(Ме) + 62) / (Мэ(Ме) + 17);
Мэ(Ме) = 15 г/моль.
Пример 7. В какой массе Са(ОН)2 содержится столько же эквивалентов, сколько в 312г А1(ОН)3?
Решение. Эквивалентная масса Аl(ОН)3 равна 1/3 его мольной массы, т.е. 78/3 = =26 г/моль. Следовательно, в 312 г А1(ОН)з содержится 312/26 =12 эквивалентов. Эквивалентная масса Са(ОН)2 равна 1/2 его мольной массы, т.е. 37 г/моль. Отсюда 12 эквивалентов составляют 37 г/моль · 12 моль =444 г.
Пример 8. Вычислите абсолютную массу молекулы серной кислоты в граммах.
Решение. Моль любого вещества (см. пример 1) содержит постоянную Авогадро NA структурных единиц (в нашем примере молекул). Мольная масса Н2SO4 равна 98,0 г/моль. Следовательно, масса одной молекулы 98 / (6,02•1023) = 1,63∙10-22 г.
Контрольные вопросы
1. Из 3,31 г нитрата металла получается 2,78 г его хлорида. Вычислите эквивалентную массу этого металла. Ответ: 103,6 г/моль.
2. Напишите уравнения реакций Fе(ОН)3 с хлороводородной (соляной) кислотой, при которых образуются следующие соединения железа: а) хлорид дигидроксожелеза; б) дихлорид гидроксожелеза; в) трихлорид железа. Вычислите эквивалент и эквивалентную массу Fе(ОН)3 в каждой из этих реакций.
3. Избытком гидроксида калия подействовали на растворы: а) дигидрофосфата калия; б) нитрата дигидроксовисмута (III). Напишите уравнения реакций этих веществ с КОН и определите их эквиваленты и эквивалентные массы.
4. В какой массе Сг(ОН)3 содержится столько же эквивалентов, сколько в 174,96 г Мg(ОН)2. Ответ: 174 г.
5. Избытком хлороводородной (соляной) кислоты подействовали на растворы: а) гидрокарбоната кальция; б) дихлорида гидроксоалюминия. Напишите уравнения реакций этих веществ с НС1 и определите их эквиваленты и эквивалентные массы.
6. При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите эквивалентные массы металла и его оксида. Чему равны мольная и атомная массы металла?
7. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода (н.у.). Вычислите эквивалентную, мольную и атомную массы металла.
8. Исходя из мольной массы углерода и воды, определите абсолютную массу атома углерода и молекулы воды в граммах. Ответ: 2,0·10-23 г, 3,0·10-23 г.
9. На нейтрализацию 9,797 г ортофосфорной кислоты израсходовано 7,998г NaOH. Вычислите эквивалент, эквивалентную массу и основность Н3Р04 в этой реакции. На основании расчета напишите уравнение реакции. Ответ: 0,5 моль, 49 г/моль, 2.
10. На нейтрализацию 0,943 г фосфористой кислоты НзРОз израсходовано 1,291 г КОН. Вычислите эквивалент, эквивалентную массу и основность кислоты. На основании расчета напишите уравнение реакции. Ответ: 0,5 моль, 41 г/моль, 2.
11. Определите эквивалент и эквивалентную массу фосфора, кислорода и брома в соединениях РН3, Н2О, HBr.
12. В какой массе NaOH содержится столько же эквивалентов, сколько в 140 г КОН? Ответ: 100 г.
13. Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите эквивалентную массу этого металла. Ответ: 32, 5 г/моль.
14. Из 1,3 г гидроксида металла получается 2,85 г его сульфата. Вычислите эквивалентную массу этого металла. Ответ; 9 г/моль.
15.Оксид трехвалентного элемента содержит 31,58% кислорода. Вычислите эквивалентную, мольную и атомную массы этого элемента.
16. Чему равен эквивалентный объем водорода? Вычислите эквивалентную массу металла, если на восстановление 1,017 г его оксида израсходовалось 0,28 л водорода (н.у.). Ответ: 32, 68 г/моль.
17. Выразите в молях: а) 6,02·1022 молекул С2Н2; б) 1,80·1024 атомов азота;
в) 3,01·1023 молекул NН3. Какова мольная масса указанных веществ?
18. Вычислите эквивалент и эквивалентную массу Н3Р04 в реакциях образования: a) гидрофосфата; б) дигидрофосфата; в) ортофосфата.
19. В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите эквивалентные массы металла и его оксида. Чему равна мольная и атомная масса этого металла?
20. Чему равен при н.у. эквивалентный объем кислорода? На сжигание 1,5 г двухвалентного металла требуется 0,69 л кислорода (н.у.). Вычислите эквивалентную массу, мольную массу и атомную массу этого металла.
ТЕМА: Строение атома
Пример 1. Что такое квантовые числа? Какие значения они могут принимать?
Решение. Движение электрона в атоме носит вероятностный характер. Околоядерное пространство, в котором с наибольшей вероятностью (0,9—0,95) может находиться электрон, называется атомной орбиталью (АО). Атомная орбиталь, как любая геометрическая фигура, характеризуется тремя параметрами (координатами), получившими название квантовых чисел (n,ℓ,mℓ). Квантовые числа принимают не любые, а определенные, дискретные (прерывные) значения. Соседние значения квантовых чисел различаются на единицу. Квантовые числа определяют размер (n), форму (ℓ) и ориентацию (m1) атомной орбитали в пространстве. Занимая ту или иную атомную орбиталь, электрон образует электронное облако, которое у электронов одного и того же атома может иметь различную форму. Формы электронных облаков аналогичны АО. Их также называют электронными или атомными орбиталями. Электронное облако характеризуется четырьмя квантовыми числами (n, ℓ, mℓ и ms). Эти квантовые числа связаны с физическими свойствами электрона, и число n (главное квантовое число) характеризует энергетический (квантовый) уровень электрона; число ℓ (орбитальное) — момент количества движения (энергетический подуровень), число mℓ (магнитное) — магнитный момент, ms — спин. Спин электрона возникает за счет вращения его вокруг собственной оси. Электроны в атоме должны отличаться хотя бы одним квантовым числом (принцип Паули), поэтому в АО могут находиться не более двух электронов, отличающихся своими спинами (ms = ± 1/2).
Таблица 1. Значения квантовых чисел и максимальное число электронов на квантовых уровнях и подуровнях
| Квантовый | Магнитное квантовое число, ml | Число квантов-ых состояний (орбиталей) | Максимальное число электро-нов | |||||
| уровень | подуровень | |||||||
| обозна-чение | главное квантовое число, n | обозна-чение | орбитальное квантовое число, l | в под-уровне (2 l +1) | в уров-не n2 | в под-уровне (2 l +1) | в уров-не n2 | |
| K | s | |||||||
| L | s | |||||||
| p | -1; 0; +1 | |||||||
| M | s | |||||||
| p | -1; 0; +1; | |||||||
| d | -2;-1; 0; +1; +2 | |||||||
| N | s | |||||||
| p | -1; 0; +1 | |||||||
| d | -2; -1; 0; +1; +2 | |||||||
| f | -3; -2; -1; 0; +1;+2; +3; |
Пример 2. Составьте электронные формулы атомов элементов с порядковыми номерами 16 и 22. Покажите распределение электронов этих атомов по квантовым (энергетическим) ячейкам.
Решение. Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов, где n — главное квантовое число, ℓ — орбитальное квантовое числов (вместо него указывают соответствующее буквенное обозначение — s, p, d, f), х — число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией — меньшая сумма n + ℓ (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
1s→2s→ 2р→ 3s→ 3р→ 4s→ 3d→ 4р→ 5s→ 4d→ 5р→ 6s→ 5d1 →4f→ 5d→ 6р→ 7s →6d1 →5f→ 6d→ 7р
Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д.И. Менделеева, то для элементов № 16 (сера) и № 22 (титан) электронные формулы имеют вид 16S 1s2 2s2 2р63s23р4; 22Ті 1s22s22р63s23р63d24s2. Электронная структура  атома может быть изображена также в виде схем размещения электронов в квантовых (энергетических) ячейках, которые являются схематическим изображением атомных орбиталей (АО). Квантовую ячейку обозначают в виде прямоугольника , кружка О или линейки ─, а электроны в этих ячейках обозначают стрелками ↑↓. В каждой квантовой ячейке может быть не более двух электронов с противоположными спинами. В данном пособии применяют прямоугольники . Орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами (правило Хунда).
атома может быть изображена также в виде схем размещения электронов в квантовых (энергетических) ячейках, которые являются схематическим изображением атомных орбиталей (АО). Квантовую ячейку обозначают в виде прямоугольника , кружка О или линейки ─, а электроны в этих ячейках обозначают стрелками ↑↓. В каждой квантовой ячейке может быть не более двух электронов с противоположными спинами. В данном пособии применяют прямоугольники . Орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами (правило Хунда).
Контрольные вопросы
21. Какие значения могут принимать квантовые числа n, l, ml и ms, характеризующие состояние электронов в атоме? Какие значения они принимают для последнего электрона атома магния?
22. Какие из электронных формул, отражающих строение невозбужденного атома некоторого элемента неверны: а)1s22s22р53s1 б)1s22s22р6 в)1s22s22р63s23р63d4 г)1s22s22р63s23р64s2 д) 1s22s22р63s23d2. Атомам, каких элементов отвечают правильно составленные электронные формулы?
23. Напишите электронные формулы атомов элементов с порядковыми номерами 24 и 33, учитывая, что у первого происходит "провал" одного 4s-электрона на Зd-подуровень. Чему равен максимальный спин d-электронов у атомов первого и р-электронов у атомов второго элементов?
24. Квантовые числа для электронов внешнего энергетического уровня атомов некоторого элемента имеют следующие значения: п =4; l=0; m 1 =0; ms= ±1/2. Напишите электронную формулу атома этого элемента и определите, сколько свободных 3d-орбиталей он содержит.
25. В чем заключается принцип Паули? Может ли быть на каком-нибудь подуровне атома р7- или d12-электронов? Почему? Составьте электронную формулу атома элемента с порядковым номером 22 и укажите его валентные электроны.
26. Составьте электронные формулы атомов, элементов с порядковыми номерами 32 и 42, учитывая, что у последнего происходит "провал" одного 5s-электрона на 4d-подуровень. К какому электронному семейству относится каждый из этих элементов?
27. Составьте электронные формулы атомов, элементов с порядковыми номерами 12 и 38. Какими четырьмя квантовыми числами можно описать последний электрон?
28. Составьте электронные формулы атомов, элементов с порядковыми номерами 17 и 53. Какими четырьмя квантовыми числами можно описать последний электрон?
29. Составьте электронные формулы атомов, элементов с порядковыми номерами 11 и 37. Какими четырьмя квантовыми числами можно описать последний электрон?
30. Каким элементам соответствуют следующие электронные формулы:
а) 1s22s22р63s23р64s2; б) 1s22s22р63s23р2? Распределите электроны по квантовым ячейкам. К каким электронным семействам они относятся?
31. Напишите электронные формулы атомов элементов с порядковыми номерами 9 и 28. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
32. Напишите электронные формулы атомов элементов с порядковыми номерами 16 и 26. Распределите электроны этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
33. Какое максимальное число электронов могут занимать s-, р-, d- и f-орбитали данного энергетического уровня? Почему? Напишите электронную формулу атома элемента с порядковым номером 31.
34. Напишите электронные формулы атомов элементов с порядковыми номерами 25 и 34. К какому электронному семейству относится каждый из этих элементов?
35. Какие орбитали атома заполняются электронами раньше: 4s или 3d; 5s или 4р. Почему? Напишите электронную формулу атома элемента с порядковым номером 21.
36. Какие орбитали атома заполняются электронами раньше: 4d или 5s; 6s или 5р? Почему? Напишите электронную формулу атома элемента с порядковым номером 43.
37. Напишите электронные формулы атомов элементов с порядковыми номерами 14 и 40. Сколько свободных d-орбиталей у атомов последнего элемента?
38. Напишите электронные формулы атомов элементов с порядковыми номерами 15 и 28. Чему равен максимальный спин р-электронов у атомов первого и d-электронов у атомов второго элемента?
39. Напишите электронные формулы атомов элементов с порядковыми номерами 21 и 23. Сколько свободных d-орбиталей в атомах этих элементов?
40. Сколько и какие значения может принимать магнитное квантовое число ml при орбитальном числе L = 0, 1, 2 и З? Какие элементы в периодической системе называют s-, р-, d- и f-элементами? Приведите примеры.
ТЕМА: Периодическая система элементов Д.И. Менделеева
Пример 1. Какую высшую и низшую степени окисления проявляют мышьяк, селен и бром? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
Решение. Высшую степень окисления элемента определяет номер группы периодической системы Д.И. Менделеева, в которой он находится. Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении того количества электронов, которое необходимо для образования устойчивой восьмиэлектронной оболочки (ns2np6).
Данные элементы находятся соответственно в VA, VIA, VIIA-группах и имеют структуру внешнего энергетического уровня s2p3, s2p4 и s2p5. Ответ на вопрос см. табл. 2.
Таблица 2. Степени окисления мышьяка, селена, брома
| Элемент | Степень окисления Высшая Низшая | Соединения |
| As | +5 -3 | H3AsO4; H3As |
| Se | +6 -2 | SeO3; Na2Se |
| Br | +7 -1 | KBrO4; KBr |
Пример 2. У какого из элементов четвертого периода — марганца или брома — сильнее выражены металлические свойства?
Решение. Электронные формулы данных элементов
25Mn 1s22s22p63s23p63d54s2
35Br 1s22s22p63s23p63d104s24p5
Марганец — d-элемент VIIB-группы, а бром — р-элемент VIIA-группы. На внешнем энергетическом уровне у атома марганца два электрона, а у атома брома — семь. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, и, следовательно, тенденцией терять эти электроны. Они обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем энергетическом уровне содержат более трех электронов, обладают определенным сродством к электрону, а, следовательно, приобретают отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, марганец, как и все металлы, обладает только восстановительными свойствами, тогда как для брома, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих р- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у марганца сильнее выражены, чем у брома.
Пример 3. Как зависят кислотно-основные свойства оксидов и гидроксидов от степени окисления атомов элементов, их образующих? Какие гидроксиды называются амфотерными?
Решение. Если данный элемент проявляет переменную степень окисления и образует несколько оксидов и гидроксидов, то с увеличением степени окисления свойства последних меняются от основных к амфотерным и кислотным. Это объясняется характером электролитической диссоциации (ионизации) гидроксидов МеОН, которая в зависимости от сравнительной прочности и полярности связей Ме — О и О — Н может протекать по двум типам:
МеОН ↔ Меn++nОН- (1) МеОН ↔ МеО-+Н+ (II) 
Полярность связей, в свою очередь, определяется разностью электроотрицательностей компонентов, размерами и эффективными зарядами атомов. Диссоциация по кислотному типу (II) протекает, если Эон < ЭЭО (высокая степень окисления), а по основному типу (1), если Эон > Ээо (низкая степень окисления); Если прочности связей О—Н и Э—О близки или равны, диссоциация гидроксида может одновременно протекать и по (I), и по (II) типам. В этом случае речь идет об амфотерных электролитах.
Эn++nОН-- ↔ Э(ОН)n ↔ HnЭОn ↔ nH++ЭОnn+
как основание как кислота
Э-элемент, n-его положительная степень окисления В кислой среде амфолит проявляет основной характер, а в щелочной среде - кислый характер.
Контрольные вопросы
41. У какого из р-элементов пятой группы периодической системы — фосфора или сурьмы — сильнее выражены неметаллические свойства? Какое из водородных соединений данных элементов более сильный восстановитель? Ответ мотивируйте строением атома этих элементов.
42. Исходя из положения металла в периодической системе, дайте мотивированный ответ на вопрос: какой из двух гидроксидов более сильное основание: Ва (ОН)2 или Mg(OH)2, Ca(OH)2 или Fe(OH)2, Са(OH)2 или Sr(OH)2?
43. Исходя из степени окисления атомов соответствующих элементов, дайте мотивированный ответ на вопрос: какой из двух гидроксидов является более сильным основанием: Cu(OH) или Си(ОН)2; Fe(OH)2 или Fe(OH)3; Sn(OH)2 или Sn(OH)4? Напишите уравнения реакций, доказывающих амфотерность гидроксида олова (II).
44. Какую низшую степень окисления проявляют водород, фтор, сера и азот? Почему? Составьте формулы соединений кальция с данными элементами в этой их степени окисления. Как называются соответствующие соединения?
45. Какую низшую и высшую степени окисления проявляют кремний, мышьяк, селен и хлор? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
46. Хром образует соединения, в которых он проявляет степени окисления +2, +3, +6. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления. Напишите уравнения реакций, доказывающих амфотерность гидроксида хрома (III).
47. Атомные массы элементов в периодической системе непрерывно увеличиваются, тогда, как свойства простых тел изменяются периодически. Чем это можно объяснить? Дайте мотивированный ответ.
48. Какова современная формулировка периодического закона? Объясните, почему в периодической системе элементов аргон, кобальт, теллур и торий помещены соответственно перед калием, никелем, йодом и протактинием, хотя и имеют большую атомную массу?
49. Какую низшую и высшую степени окисления проявляют углерод, фосфор, сера и йод? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
50. Атомы каких элементов четвертого периода периодической системы образуют оксид, отвечающий их высшей степени окисления Э2О5? Какой из них дает газообразное соединение с водородом? Составьте формулы кислот, отвечающих этим оксидам, и изобразите их графически?
51. Исходя из положения германия и технеция в периодической системе, составьте формулы мета-, ортогерманиевой кислот и оксида технеция, отвечающие их высшей степени окисления. Изобразите формулы этих соединений графически.
52. Что такое энергия ионизации? В каких единицах она выражается? Как изменяется восстановительная активность s- и р-элементов в группах периодической системы с увеличением порядкового номера? Почему?
53. Что такое электроотрицательность? Как изменяется электроотрицательность р-элементов в периоде, в группе периодической системы с увеличением порядкового номера? Почему?
54. Исходя из положения германия, молибдена и рения в периодической системе, составьте формулы водородного соединения германия, оксида молибдена и рениевой кислоты, отвечающие их высшей степени окисления. Изобразите формулы этих соединений графически.
55. Что такое сродство к электрону? В каких единицах оно выражается? Как изменяется окислительная активность неметаллов в периоде и в группе периодической системы с увеличением порядкового номера? Ответ мотивируйте строением атома соответствующего элемента.
56. Составьте формулы оксидов и гидроксидов элементов третьего периода периодической системы, отвечающих их высшей степени окисления. Как изменяется кислотно-основной характер этих соединений при переходе от натрия к хлору? Напишите уравнения реакций, доказывающих амфотерность гидроксида алюминия.
57. Какой из элементов четвертого периода — ванадий или мышьяк — обладает более выраженными металлическими свойствами? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте, исходя из строения атомов этих элементов.
58. Марганец образует соединения, в которых он проявляет степень окисления +2, +3 +4; +6, +7. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления. Напишите уравнения реакций, доказывающих амфотерность гидроксида марганца (IV).
59. У какого элемента четвертого периода — хрома или селена — сильнее выражены металлические свойства? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте строением атомов хрома и селена
60. Какую низшую степень окисления проявляют хлор, сера, азот и углерод? Почему? Составьте формулы соединений алюминия с данными элементами в этой степени окисления. Как называются соответствующие соединения?
ТЕМА: Химическая связь и строение молекул. Конденсированное состояние вещества.
Пример 1. Какую валентность, обусловленную неспаренными электронами (спин-валентность), может проявлять фосфор в нормальном и возбужденном (*) состояниях?
Решение. Распределение электронов внешнего энергетического уровня фосфора …3s2 Зр3 (учитывая правило Хунда, 3s2 ЗрX ЗрУ ЗрZ) по квантовым ячейкам имеет вид:

Атомы фосфора имеют свободные d-орбитали, поэтому возможен переход одного 3s-электрона в Зd-состояние:

Отсюда валентность (спинвалентность) фосфора в нормальном состоянии равна трем, а в возбужденном — пяти.
Пример 2. Что такое гибридизация валентных орбиталей? Какое строение имеют молекулы типа АВn, если связь в них образуется за счет sp-, sp2-, sp3- гибридизации орбиталей атома А?
Решение. Теория валентных связей (ВС) предполагает участие в образовании ковалентных связей не только «чистых» АО, но и «смешанных», так называемых гибридных, АО. При гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и образуются орбитали (облака) новой одинаковой формы и одинаковой энергии. Число гибридных орбиталей (q) равно числу исходных. Ответ на поставленный вопрос отражен в табл.3.
Таблица 3. Гибридизация орбиталей и пространственная конфигурация молекул.
| Тип молекулы | Исходные орбитали атома А | Тип гибридизации | Число гибридных орбиталей атома А | Пространственная конфигурация молекулы | |
| АВ2 | s+p | sp | Линейная | ||
| АВ3 | s+p+p | sp2 | Треугольная | ||
| АВ4 | s+p+p+p | sp3 | Тетраэдрическая |
Пример 3. Как метод молекулярных орбиталей (МО) описывает строение двухатомных гомоядерных молекул элементов второго периода?
Решение. Метод валентных связей (ВС) не может объяснить целый ряд свойств и строение некоторых молекул (парамагнетизм молекулы О2, большую прочность связей в молекулярных ионах F2+ и О2+, чем, соответственно, в молекулах F2 и О2; меньшую прочность связи в ионе N2+, чем в молекуле N2; существование молекулярного иона Не2+ и неустойчивость молекулы Не2; и т.п.). Более плодотворным оказался другой подход к объяснению ковалентной связи — метод молекулярных орбиталей (МО). В методе МО состояние молекулы описывается как совокупность электронных молекулярных орбиталей. При этом число молекулярных орбиталей равно сумме атомных орбиталей. Молекулярной орбитали, возникающей от сложения атомных орбиталей (АО), соответствует более низкая энергия, чем исходным орбиталям. Такая МО имеет повышенную электронную плотность в пространстве между ядрами, способствует образованию химической связи и называется связывающей. Молекулярной орбитали, образовавшейся от вычитания атомных, соответствует более высокая энергия, чем атомным орбиталям. Электронная плотность в этом случае сконцентрирована за ядрами атомов, а между ними равна нулю. Подобные МО энергетически менее выгодны, чем исходные АО, они приводят к ослаблению химической связи и называются разрыхляющими. Электроны, занимающие связывающие и разрыхляющие орбитали, называют соответственно связывающими (cв) и разрыхляющими (разр.) электронами. Заполнение молекулярных орбиталей происходит при соблюдении принципа Паули и правила Хунда по мере увеличения их энергии в такой последовательности:
σсв1s<σразр1s<σсв2s<σразр2s<σсв2рx<πсв2ру=πсв2рz<πразр2ру=πразр2рz<σразр2рx
Энергетическая схема образования молекулярных орбиталей из атомных для двухатомных гомоядерных (одного и того же элемента) молекул элементов второго периода дана в учебнике «Общая химия» Н.Л.Глинка.
Следует отметить, что при образовании молекул В2, С2 и N2 энергия связывающей σ2рх,-орбитали больше энергии связывающих π2pу- и π2рz-орбиталей, тогда как в молекулах О2 и F2, наоборот, энергия связывающих π2pу- и π2рz-орбитапей больше энергии связывающей σ2рх-орбитали. Это нужно учитывать при изображении энергетических схем («Общая химия» Н.Л.Глинка) соответствующих молекул.
Порядок связи в молекуле определяется разностью между числом связывающих и разрыхляющих электронов, деленной на два. Порядок связи может быть равен нулю (молекула не существует), целому или дробному положительному числу.

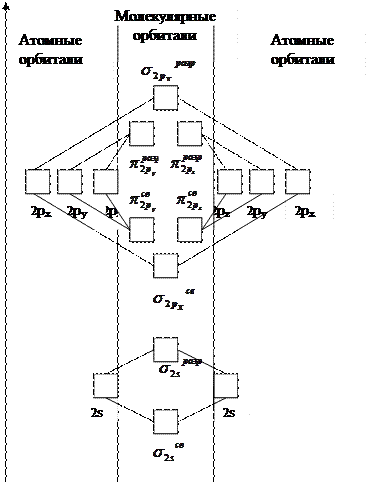
Рис.1. Энергетическая схема образования молекулярных орбиталей из атомных для гомоядерных молекул второго периода.
Контрольные вопросы
61. Нарисуйте энергетическую схему образования молекулы Не2 и молекулярного иона Не2+ по методу молекулярных орбиталей. Как метод МО объясняет устойчивость иона Не2+ и невозможность существования молекулы Не2?
62. Какую химическую связь называют водородной? Между молекулами каких веществ она образуется? Почему Н2О и HF, имея меньшую молекулярную массу, плавятся и кипят при более высоких температурах, чем их аналоги?
63. Какую химическую связь называют ионной? Каков механизм ее образования? Какие свойства ионной связи отличают ее от ковалентной? Приведите два примера типичных ионных соединений. Напишите уравнения превращения соответствующих ионов в нейтральные атомы.
64. Что следует понимать под степенью окисления атома? Определите степень окисления атома углерода и его валентность, обусловленную числом неспаренных электронов, в соединениях СН4, СН3ОН, НСООН, СО2.
65. Какие силы молекулярного взаимодействия называют ориентационными, индукционными и дисперсионными? Когда возникают эти силы и какова их природа?
66. Нарисуйте энергетическую схему образования молекулярного иона Н2- и молекулы Н2 по методу молекулярных орбиталей. Где энергия связи больше? Почему?
67. Какие электроны атома бора участвуют в образовании ковалентных связей? Как метод валентных связей (ВС) объясняет симметричную треугольную форму молекулы ВF3?
68. Нарисуйте энергетическую схему образования молекулы О2 по методу молекулярных орбиталей (МО). Как метод МО объясняет парамагнитные свойства молекулы кислорода?
69. Нарисуйте энергетическую схему образования молекул F2 по методу молекулярных орбиталей (МО). Сколько электронов находится на связывающих и разрыхляющих орбиталях? Чему равен порядок связи в этой молекуле?
70. Нарисуйте энергетическую схему образования молекулы N2 по методу молекулярных орбиталей (МО). Сколько электронов находится на связывающих и разрыхляющих орбиталях? Чему равен порядок связи в этой молекуле?
71. Какую химическую связь называют ковалентной? Чем можно объяснить направленность ковалентной связи? Как метод валентных связей (ВС) объясняет строение молекулы воды?
72. Какую ковалентную связь называют полярной? Что служит количественной мерой полярности ковалентной связи? Исходя из значений электроотрицательности атомов соответствующих элементов, определите, какая из связей: HI, ICℓ, BrF — наиболее полярна.
73. Какой способ образования ковалентной связи называют донорно-акцепторным? Какие химические связи имеются в ионах NH4+ и BF4-. Укажите донор и акцептор.
74. Как метод валентных связей (ВС) объясняет линейное строение молекулы BeC12 и тетраэдрическое СН4?
75. Какую ковалентную связь называют σ-связью и какую π-связью? Разберите на примере строения молекулы азота.
76. Сколько неспаренных электронов имеет атом хлора в нормальном и возбужденном состояниях? Распределите эти электроны по квантовым ячейкам. Чему равна валентность хлора, обусловленная неспаренными электронами?
77. Распределите электроны атома серы по квантовым ячейкам. Сколько неспаренных электронов имеют ее атомы в нормальном и возбужденных состояниях? Чему равна валентность серы, обусловленная неспаренными электронами?
78. Что называют электрическим моментом диполя? Какая из молекул НС1, НВг, HI имеет наибольший момент диполя? Почему?
79. Какие кристаллические структуры называют ионными, атомными, молекулярными и металлическими? Кристаллы каких веществ: алмаз, хлорид натрия, диоксид углерода, цинк — имеют указанные структуры?
80. Как метод валентных связей (ВС) объясняет угловое строение молекул H2S и линейное молекулы СО2?
ТЕМА: Энергетика химических процессов (термохимические расчеты)
При решении задач этого раздела данные для расчетов необходимо взять в таблице этого раздела и в справочнике физико-химических величин.
Науку о взаимных превращениях различных видов энергии называют термодинамикой. Термодинамика устанавливает законы этих превращений, а также направление самопроизвольного течения различных процессов в данных условиях.
В результате химических реакций происходят глубокие качественные изменения в системе, рвутся связи в исходных веществах и возникают новые связи в конечных продуктах. Эти изменения сопровождаются поглощением или выделением энергии. В большинстве случаев этой энергией является теплота. Раздел термодинамики, изучающий тепловые эффекты химических реакций, называют термохимией. Реакции, которые сопровождаются выделением теплоты, называют экзотермическими, а те, которые сопровождаются поглощением теплоты, — эндотермическими. Теплоты реакций являются, таким образом, мерой изменения свойств системы, и знание их может иметь большое значение при определении условий протекания тех или иных реакций.
При любом процессе соблюдается закон сохранения энергии как проявление более общего закона природы — закона сохранения материи. Теплота Q, поглощенная системой, идет на изменение ее внутренней энергии ΔU и на совершение работы А:

Внутренняя анергия системы U— это общий ее запас, включающий энергию поступательного и вращательного движения молекул, энергию внутримолекулярных колебаний атомов и атомных групп, энергию движения электронов, внутриядерную энергию и т.д. Внутренняя энергия — полная энергия системы без потенциальной энергии, обусловленной положением системы в пространстве, и без кинетической энергии системы как целого. Абсолютное значение внутренней энергии U веществ неизвестно, так как нельзя привести систему в состояние, лишенное энергии. Внутренняя энергия, как и любой вид энергии, является функцией состояния, т.е. ее изменение однозначно определяется начальным и конечным состоянием системы и не зависит от пути перехода, по которому протекает процесс ΔU = U2 — U1, где ΔU — изменение внутренней энергии системы при переходе от начального состояния U1 в конечное U2. Если U2 > U1, то ΔU > 0. Если U2 < U1, то ΔU < 0.
Теплота и работа функциями состояния не являются, ибо они служат формами передачи энергии и связаны с процессом, а не с состоянием системы. При химически реакциях А — это работа против внешнего давления, т.е. в первом приближении А = ρΔV, где ΔV - изменение объема системы (V2 – V1). Так как большинство химических реакций проходит при постоянном давлении, то для иэобарно-изотермического процесса (p-const, Т-const) теплота
Qр = ΔU + ρΔV,
Qр = (U2 — U1) + ρ(V2 – V1)
Сумму U + ρV обозначим через Н, тогда
Qр= Н2 - Н1= ΔН
Величину Н называют энтальпией. Таким образом, теплота при р=соnst и T=сопst приобретает свойство функции состояния и не зависит от пути, по которому протекает процесс. Отсюда теплота реакции в иэобарно-иэотермическом процессе Qp равна изменению энтальпии системы ΔН (если единственным видом работы является работа расширения):
Энтальпия, как и внутренняя энергия, является функцией состояния; ее изменение {ΔН} определяется только начальными и конечными состояниями системы и не зависит от пути перехода. Нетрудно видеть, что теплота реакции в иэохорно-изотермическом процессе (Vсonst; T=соnst), при котором ΔV = 0, равна изменению внутренней энергии системы:Qv=ΔU
Теплоты химических процессов, протекающих при р,Т =соnst V,T =const, называют тепловыми аффектами.
При экзотермических реакциях энтальпия системы уменьшается и ΔН < О (H2 < H1), а при эндотермических энтальпия системы увеличивается и ΔH > О (H2>H1). В дальнейшем тепловые эффекты всюду выражаются через ΔН.
Термохимические расчеты основаны на законе Гесса: тепловой эффект реакции зависит только от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от пути перехода.
Часто в термохимических расчетах применяют следствие из закона Гесса: тепловой эффект реакции ΔHх.р. равен сумме теплот образования ΔНобр продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом коэффициентов перед формулами этих веществ в уравнении реакции.
Пример 1. При взаимодействии кристаллов хлорида фосфора (V) с парами воды образуется жидкий РОС1з и хлористый водород. Реакция сопровождается выделением 111,4 кДж теплоты. Напишите термохимическое уравнение этой реакции.
Решение. Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также численное значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qр равные изменению энтальпии системы ΔН.
Значение ΔН приводят обычно в правой части уравнения, отделяя его запятой или точкой с запятой. Приняты следующие сокращенные обозначения агрегатного состояния веществ: г — газообразное, ж — жидкое, к — кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно.
Если в результате реакции выделяется теплота, то ΔН < О. Учитывая сказанное, составляем термохимическое уравнение данной в примере реакции:
РCl5(к) + H2O(г) = POCl3(ж) + 2HCl(г); ΔНх.р.=-111,4кДж
Таблица 4. Стандартные теплоты (энтальпии) образования ΔНо298 некоторых веществ
| Вещество | Состояние | ΔНо298, кДж/моль | Вещество | Состояние | ΔНо298, кДж/моль |
| С2Н2 | г | +226,75 | СО | г | -110,52 |
| СS2 | г | +115,28 | СН3ОН | г | -201,17 |
| NO | г | +90,37 | С2Н5ОН | г | -235,31 |
| С6Н6 | г | +82,93 | Н2О | г | -241,83 |
| С2Н4 | г | +52,28 | Н2О | ж | -285,84 |
| Н2S | г | -20,15 | NH4Cl | к | -315,39 |
| NH3 | г | -46,19 | СО2 | г | -393,51 |
| СН4 | г | -74,85 | Fe2O3 | к | -822,10 |
| С2Н6 | г | -84,67 | Са(ОН)2 | к | -986,50 |
| НС1 | г | -92,31 | А12О3 | к | -1669,80 |
| TiO2 | к | -943,9 |
Пример 2. Реакция горения этана выражается термохимическим уравнением
С2Н6(г) +3 1/2О2=2СО2(г)+3Н2О(ж); ΔНхр= -1559,87 кДж
Вычислите теплоту образования этана, если известны теплоты образования СО2 (г) и Н2О (ж) (табл. 4).
Решение. Теплотой образования (энтальпией) данного соединения называют тепловой эффект реакции образования 1 моль этого соединения из простых веществ, взятых в их устойчивом состоянии при данных условиях.
Обычно теплоты образования относят к стандартному состоянию, т.е. 25° С (298 К) и 1,013·105 Па, и обозначают через ΔНо298.  Так как тепловой эффект с температурой изменяется незначительно, то здесь и в дальнейшем индексы опускаются и тепловой эффект обозначается через ΔН. Следовательно, нужно вычислить тепловой эффект реакции, термохимическое уравнение которой имеет вид
Так как тепловой эффект с температурой изменяется незначительно, то здесь и в дальнейшем индексы опускаются и тепловой эффект обозначается через ΔН. Следовательно, нужно вычислить тепловой эффект реакции, термохимическое уравнение которой имеет вид
2С (графит) + 3Н2(г) = С2Н6(г); ΔН =?
исходя из следующих данных:
а) С2Н6 (г) + 31/2 О2 (г) = 2 СО2 (г) + 3Н2О (ж); ΔН = -1559,87 кДж
б) С (графит) + О2 (г) = СО2 (г); ΔН = -393,51 кДж
в) H2 (г) + 1/2 О2 = Н2О (ж) ΔН = -285,84 кДж
На основании закона Гесса с термохимическими уравнениями можно оперировать так же, как и с алгебраическими. Для получения искомого результата следует уравнение (б) умножить на 2, уравнение (в) - на 3, а затем сумму этих уравнений вычесть из уравнения (а):
С2Н6 (г) + 31/2 О2 (г) – 2 С - 2 О2 (г) - 3Н2 - 3/2 О2 = 2СО2 + 3Н2О – 2СО2 – 3Н2О
ΔН = -1559,87 – 2 (-393,51) – 3 (-285,84) = +84,67 кДж;
ΔН = -1559,87 + 787,02 + 857,52;
C2Н6 = 2 С + 3 Н2; ΔН = +84,67 кДж.
Так как теплота образования равна теплоте разложения с обратным знаком, то ΔНC2Н6(г) = - 84,67 кДж.
К тому же результату придем, если для решения задачи применить вывод из закона Гесса:
ΔНхр=2ΔНсо2+3ΔНн2о-ΔНс2н6-3½ΔНо2
Учитывая, что теплоты образования простых веществ условно приняты равными нулю
ΔН(с2н6)=2ΔНсо2+3ΔНн2о-ΔНх.р.
ΔН(с2н6)=2(-393,51)+3(-285,84)+1559,87=-84,67;
ΔНобр(с2н6(г))=-84,67кДж
Пример 3. Реакция горения этилового спирта выражается термохимическим уравнением С2Н5ОН(ж)+3О2(г)=2СО2(г)+3Н2О(ж); ΔН=?
Вычислите тепловой эффект реакции, если известно, что мольная (молярная) теплота парообразования С2Н5ОН(ж) равна +42,36 кДж и известны теплоты образования С2Н5ОН(г); СО2(г); Н2О(ж) (см. табл. 4).
Решение. Для определения ΔН реакции необходимо знать теплоту образования С2Н5ОН (ж). Последнюю находим из данных:
С2Н5ОН(ж) = С2Н5ОН(г) ΔН=+42,36кДж
+42,36=-235,31-ΔНс2н5он(ж)
ΔН(с2н5он(ж))=-235,31-42,36= -277,67кДж
Вычисляем ΔН реакции применяя следствия из закона Гесса:
ΔНх.р.= 2 (-393,51)+3 (-285,84)+277,67=-1366,87кДж
Контрольные вопросы
81. Вычислите, сколько теплоты выделится при сгорании 165 л (н.у.) ацетилена С2Н2, если продуктами сгорания являются диоксид углерода и пары воды? Ответ: 9248,8 кДж.
82. При сгорании газообразного аммиака образуются пары воды и оксид азота. Сколько теплоты выделится при этой реакции, если было получено 44,8 л NO в пересчете на нормальные условия? Ответ: 452.37 кДж.
83. Реакция горения метилового спирта выражается термохимическим уравнением
СН3ОН(ж) + 3/2О2 (г) = СО2 (г) + 2Н2О (ж); ΔH =?
Вычислите тепловой эффект этой реакции, если известно, что мольная теплота парообразования CН3ОН (ж) равна +37,4 кДж. Ответ: —726,62 кДж.
84. При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования С2Н5ОН (ж). Ответ: -277,67 кДж/моль.
85. Реакция горения бензола выражается термохимическим уравнением
С6Н6(ж)+7½О2(г)=6СО2(г)+3Н2О(г)׃ ΔН=?
Вычислите тепловой эффект этой реакции, если известно, что мольная теплота парообразования бензола равна +33,9 кДж. Ответ: -3135,58 кДж.
86. Вычислите тепловой эффект и напишите термохимическое уравнение реакции горения 1 моль этана С2Н6 (г), в результате которой образуются пары воды и диоксид углерода. Сколько теплоты выделится при сгорании 1 м3 этана в пересчете на нормальные условия? Ответ: 63742,86 кДж.
87.Реакция горения аммиака выражается термохимическим уравнением
4NH3 (г) + 3О2 (г) = 2N2 (г) + 6Н2О (ж); ΔН = 1530,28 кДж
Вычислите теплоту образования NН3 (г). Ответ: - 46.19 кДж/моль.
88. При взаимодействии 6,3 г железа с серой выделилось 11,31 кДж теплоты. Вычислите теплоту образования сульфида железа FeS. Oтвет; -100,26 кДж/моль.
89. При сгорании 1 л ацетилена (н.у.) выделяется 56,053 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования С2Н2 (г). Ответ: 226,75 кДж/моль.
90. При получении эквивалентной массы гидроксида кальция из СаО (к) и Н2О (ж) выделяется 32,53 кДж теплоты. Напишите термохимическое уравнение этой реакции и вычислите теплоту образования оксида кальция. Ответ: —635,6 кДж/моль.
91. Вычислите, какое количество теплоты выделится при восстановлении Fe2O3 металлическим алюминием, если было получено 335,1 г железа. Ответ: 2543.1 кДж.
92. Газообразный этиловый спирт С2Н5ОН можно получить при взаимодействии этилена С2Н4 (г) и водяных паров. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Ответ: —45,76 кДж.
93. Вычислите тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений
FeO + CO (г) = Fe (к) + СО2 (г); ΔH = -13,18 кДж
СО (г) + 1/2 О2 (г) = СО2(г); ΔH = -283,0 кДж
Н2 (г) + 1/2О2 (г) = Н2О (г); ΔH = -241,83 кДж
Ответ: +27,99 кДж.
94. При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерод СS2 (г). Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Ответ: +65,43 кДж.
95. Напишите термохимическое уравнение реакции между СО (г) и водородом, в результате которой образуются СН4 (г) и Н2О (г). Сколько теплоты выделится при этой реакции, если было получено 67,2 л метана в пересчете на нормальные условия? Ответ: 618,48кДж.
96. Тепловой эффект какой реакции равен теплоте образования NO? Вычислите теплоту образования NО, исходя из следующих термохимических уравнений:
4NH3 (г) + 5О2 (г) = 4NO (г) + 6Н2О (ж); ΔН = -1168,80 кДж
4NH3 (г) + 3О2 (г) = 2N2 (г) + 6Н2О (ж); ΔН = - 1530,28 кДж
Ответ: 90,37 кДж.
97. Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлористого водорода. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Сколько теплоты выделится, если в реакции было израсходовано 10 л аммиака в пересчете на нормальные условия? Ответ: 78,97 кДж.
98. Тепловой эффект какой реакции равен теплоте образования метана? Вычислите теплоту образования метана, исходя из следующих термохимических уравнений:
Н2 (г) + 1/2О2 (г) = Н2О (ж); ΔН = -285,84 кДж
С (к) + О2 (г) = СО2 (г); ΔН = -393,51 кДж
СН4 (г) + 2О2 (г) = 2Н2О (ж) + СО2 (г); ΔН = -890,31 кДж
Ответ: -74,88 кДж.
99. Тепловой эффект какой реакции равен теплоте образования гидроксида кальция? Вычислите теплоту образования гидроксида кальция, исходя из следующих термохимических уравнений:
Са (к) + 1/2О2 (г) = СаО (к); ΔН = -635,60 кДж
Н2 (г) + 1/2О2 = Н2О (ж); ΔН = -285,84 кДж
СаО (к) + Н2О (ж) = Са(ОН)2 (к); ΔН = -65,06 кДж
Ответ: -986,50 кДж.
100. Тепловой эффект реакции сгорания жидкого бензола с образованием паров воды и диоксида углерода равен -3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования C6Н6 (ж).
Ответ: +49.03 кДж.
ТЕМА: Химическое сродство
При решении задач этого раздела данные для расчетов необходимо взять в таблице этого раздела и в справочнике физико-химических величин.
Самопроизвольно могут протекать реакции, сопровождающиеся не только выделением, но и поглощением теплоты.
Реакция, идущая при данной температуре с выделением теплоты, при другой температуре проходит с поглощением теплоты. Здесь проявляется диалектический закон единства и борьбы противоположностей. С одной стороны, система стремится к упорядочению (агрегации), к уменьшению энтальпии Н; с другой стороны, система стремится к беспорядку (дезагрегации). Первая тенденция растет с понижением температуры, а вторая — с повышением температуры. Тенденцию к беспорядку характеризует величина, которую называют энтропией.
Энтропия S, так же как внутренняя энергия U, энтальпия Н, объем V и др., является свойством вещества, пропорциональным его количеству. Энтропия отражает движение частиц вещества и является мерой неупорядоченности системы. Она возрастает с увеличением движения частиц: при нагревании, испарении, плавлении, расширении газа, при ослаблении или разрыве связей между атомами и т.п. Процессы, связанные с упорядоченностью системы (конденсация, кристаллизация, сжатие, упрочнение связей, полимеризация и т.п.), ведут к уменьшению энтропии. Энтропия является функцией состояния, т.е. ее изменение (ΔS) зависит только от начального (S1) и конечного (S2) состояния и не зависит от пути процесса
ΔSх.р.=ΣS0 прод –&#
 2015-10-22
2015-10-22 850
850








