1.Чем отличаются реальные газы от идеальных? Изобразите графически и обсудите характер взаимодействия двух молекул в зависимости от расстояния между их центрами.
2.Объясните смысл поправок а и b в уравнении Ван-дер-Ваальса: 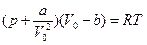 . В каких единицах измеряются постоянные Ван-дер-Ваальса?
. В каких единицах измеряются постоянные Ван-дер-Ваальса?
3.Изобразите на диаграмме р-V изотермы Ван-дер-Ваальса. Сравните их с экспериментальными изотермами. Какая температура и какое состояние называются критическими?
4.Получите соотношения, связывающие критические параметры и постоянные Ван-дер-Ваальса реального газа: 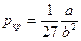 ;
; 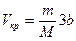 ;
; 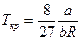 .
.
5.Изобразите графически: а) температурный ход плотности жидкости и насыщенного пара; б) зависимость давления насыщенного пара от температуры. Имеет ли смысл понятие насыщенного пара при температурах, выше критической?
6.При каких условиях могут существовать пересыщенный пар и перегретая жидкость?
7.Получите выражение для внутренней энергии реального газа. Какие методы получения низких температур и сжижения реальных газов вы знаете?
8.Что называется: испарением; сублимацией; удельной теплотой испарения; удельной теплотой сублимации?
9.Что называется: плавлением; удельной теплотой плавления? Изобразите кривую плавления вещества на диаграмме р-V.
10.При каких условиях возможно существование переохлажденной жидкости? Каковы особенности жидкого и твердого состояний вещества?
11.Что называется фазовым переходом? Чем различаются фазовые переходы I и II рода? Запишите уравнение Клапейрона—Клаузиуса. Дайте определение удельной теплоты фазового перехода.
12.Изобразите на диаграмме состояния вещества р-Т кривые испарения, сублимации и плавления. Какая точка на этой диаграмме называется тройной? Что эта точка означает?
ЗАДАЧИ
10.1.В баллоне объемом V = 30 л находится азот массой m = 0,6 кг. Найти: а) собственный объем молекул азота V.; б) внутреннее давление азота pi.
10.2.В баллоне объемом V = 3 л находится кислород массой m = 0,48 кг при температуре Т = 300 К. Определить давление р кислорода: а) по уравнению Ван-дер-Ваальса; б) по уравнению Менделеева – Клапейрона.
10.3.Найти давление р, при котором должен находиться 1 кмоль азота, что бы при температуре Т = 300 К он занимал объем V = 1,2 м3.
10.4.Критические параметры для воды имеют следующие значения Ткр =647 К, ркр = 22 МПа. Используя эти данные, вычислить для воды постоянные Ван-дер-Ваальса а и b.
10.5.Определить критическую плотность ρкр воды, если постоянная Ван-дер-Ваальса для воды b = 0,03 m3/кмоль.
10.6.Определить критические параметры Tкр, ркр, Vкр для 1 кмоля углекислого газа.
10.7.Найти критическую плотность ρкр гелия, если Ткр = 5,2 К, ркр = 0,227 МПа.
10.8.При какой температуре Т1 кмоль кислорода будет занимать объем V = 0,80 м3, если его давление р = 3 МПа. Критические параметры для кислорода: Tкр = 154 К, ркр = 5 МПа.
10.9.Определить давление р, при котором должен находиться 1 кмоль азота, чтобы при температуре Т = 300 К он занимал объем V = 1,2 м3. Критические параметры для азота: Ткр = 127 К, ркр = 3,3 МПа.
10.10.Определить, во сколько раз N давление газа больше его критического давления, если известно, что его объем и температура вдвое больше критических значений этих параметров.
10.11.Определить работу А внутренних сил взаимодействия молекул азота массой m = 0,14 кг при его расширении от объема V1 = 1,5 м3 до объема V2 = 15 м3.
10.12.Найти работу A, совершаемую 1 молем реального газа при изотермическом расширении. Известны: температура Т, начальный Vl и конечный V2 объемы газа, а также постоянные Ван-дер-Ваальса а и b.
10.13.Один киломоль некоторого газа занимает объем V = 2 м3. При расширении газа до объема V = 12 м3 была совершена работа против внутренних сил взаимодействия молекул А = 10,2 кДж. Найти для этого газа постоянную Ван-дер-Ваальса а.
10.14.Один киломоль азота изометрически расширяется от объема V1 = 0,90 м3 до объема V2 = 4,5 м3 при температуре Т = 300 К. Найти: а) приращение внутренней энергии ΔU газа; б) работу А, совершенную газом; в) количество теплоты Q, поглощенное газом.
10.15.Два теплоизолированных баллона соединены краном. В баллоне объемом V1 находится 1 моль газа, для которого молярная теплоемкость СV и постоянная Ван-дер-Ваальса а известны. Баллон объемом V2 откачан до высокого вакуума. Кран открывают, и газ адиабатически расширяется. Найти: а) приращение внутренней энергии ΔV газа; б) работу А1, совершенную газом против внутренних сил взаимодействия молекул; в) приращение температуры ΔT газа.
10.16.Азот массой 14 г адиабатически расширяется в вакуум от объема V1 = 1,2 м3 до объема V2 = 2,4 м3. Найти понижение температуры Δt азота при этом расширении.
10.17.Один киломоль трехатомного газа адиабатически расширяется в вакуум от объема V1 = 1,2 м3 до объема V2 = 2,4 м3. При этом температура газа понижается на ΔT = 6,1 К. На основании этих данных найти постоянную Ван-дер-Ваальса а газа. Молекулы газа считать жесткими.
10.18.Один киломоль азота адиабатически расширяется в вакуум от объема V1 = 1,2 м3 до объема V2 = 2,4 м3. При этом температура азота понижается на ΔT = 2,8 К. Считая молекулы азота жесткими, определить постоянную Ван-дер-Ваальса а для азота.
10.19.Углекислый газ массой 22 г адиабатически расширяется в вакуум. При этом температура углекислого газа уменьшается на ΔT = 1,4 К. Определить работу А, совершенную газом против внутренних сил взаимодействия молекул.
10.20.Найти приращение энтропии ΔS 1 моля газа при его изотермическом расширении от объема V1 до объема V2. Постоянная Ван-дер-Ваальса b для данного газа известна.
10.21.Давление насыщенных паров воды при температуре t = 100° С составляет р = 101 кПа. Найти плотность ρ насыщенных паров воды при той же температуре.
10.22.Во сколько раз N плотность воды больше плотности насыщенных водяных паров при температуре t = 20 С. Давление насыщенных водяных паров при этой температуре р = 2,33 кПа.
10.23.Давление насыщенных паров воды при температуре t1 = 100° С составляет р1 = 101 кПа, а при t2 = 200° С р2 = 1,55 МПа. Во сколько раз N плотность насыщенных водяных паров при температуре t2 больше их плотности при t1?
10.24.Давление насыщенных паров воды при температуре tl = 20° С р1 = 2,33 кПа, а при температуре t2 = 100° С р2 = 101 кПа. Во сколько раз N плотность насыщенных водяных паров при температуре t2 больше их плотности при t1?
10.25.Найти число n молекул насыщенного водяного пара, содержащихся в 1 м3 при температуре t = 0 °С. Давление насыщенных паров воды при этой температуре р = 0,61 кПа.
10.26.Найти удельный объем V0 насыщенного водяного пара при температуре t = 20 °С. Давление насыщенного водяного пара при этой температуре р = 2,33 кПа.
10.27.Насыщенный водяной пар при температуре t = 20 С подвергается: а) адиабатическому сжатию: б) адиабатическому расширению. В каком из этих процессов пар становится ненасыщенным, а в каком – пересыщенным?
10.28.Большая часть поверхности Земли покрыта водой. Почему, несмотря на это, атмосфера не насыщена водяным паром?
10.29.Найти выражение для молярной теплоты испарения qM жидкости при постоянной температуре под давлением ее насыщенного пара в предположении, что уравнением состояния жидкости и ее пара является уравнение Ван-дер-Ваальса. Постоянные Ван-дер-Ваальса а и b, а также молярные объемы V0Ж и V0П жидкости и ее насыщенного пара при температуре Т считать известными.
10.30.Найти выражение для разности молярных теплоемкостей Ср - СV газа Ван-дер-Ваальса. Чему равна эта разность в критическом состоянии?
10.31.Рассмотрев цикл Карно для системы, состоящей из жидкости и ее насыщенного пара и использовав теорему Карно, выразить производную давления насыщенного пара по температуре dp/dT через удельные объемы пара Vоп, жидкости Vож и удельную теплоту парообразования q.
10.32.Вблизи t = 100° С температура кипения воды повышается на ΔT = 6,11 К при возрастании давления на Δр = 400 Па. Определить удельную теплоту парообразования Q воды. Удельный объем насыщенного пара считать равным 1,7 м3/кг. Удельным объемом воды пренебречь.
10.33.Найти удельный объем водяного пара Vоп при t1 = 100° С и нормальном давлении, если известно, что при давлении ниже нормального на Δр = 3,3 кПа температура кипения воды t2 =99,1 °С. Удельная теплота парообразования Q при 100 °С равна 2,3 МДж/кг.
10.34.При t = 100 °С удельный объем насыщенного пара воды V0 = 1,7 м3/кг. Определить понижение температуры ΔТ кипения воды при уменьшении давления ее насыщенных паров на Δр = 3 кПа. Удельная теплота парообразования воды q = 2,3 МДж/кг.
10.35.Найти изменение температуры ΔT плавления льда при повышении давления на Δр = 101 кПа. При 273 К удельный объем воды Vож = 1,0·10-3 м3/кг, удельный объем льда Vол = 1,09·10-3 м3/кг. Удельная теплота плавления льда Q = 0,33 МДж/кг.
10.36.Определить температуру T плавления льда при давлении р = 1,01 МПа. Считать, что при изменении давления от р1 = 101 кПа до р2 = 1,01 МПа удельные объемы воды и льда и удельная теплота плавления льда постоянны и равны: Vож = 1·10-3 м3/кг, Vоп = 1,09·10-3 м3/кг, λ = 0,33 МДж/кг.
10.37.Исходя из термодинамических соображений, показать, что если вещество при затвердевании расширяется, то его температура плавления с увеличением давления уменьшается.
10.38.Ромбическая сера превращается в моноклинную при Т = 369,5 К. Найти смещение ΔT точки фазового перехода серы при изменении давления на Δр = 101 кПа. Скачок удельного объема серы при фазовом превращении равен 1,4·10-5 м3/кг. Удельная теплота превращения q = 9,2 кДж/кг.
10.39.При 0 °С давление водяного пара над льдом р = 610 Па. Найти давление р водяного пара над льдом при температуре t = -1° С. Удельная теплота сублимации Q = 2,58 МДж/кг. Водяной пар над льдом считать идеальным газом.
10.40.При понижении температуры от 273 К на ΔT = 1 К давление водяного пара над льдом уменьшилось на Δр = 50 Па. Пренебрегая удельным объемом льда, найти удельный объем водяного пара Vоп над льдом. Удельная теплота сублимации льда при 273 К равна 2,58 МДж/кг.
10.41.Приращение энтропии воды массой m = 4,5 кг в результате ее перехода в насыщенный пар при температуре t = 100° С равно 27,2 кДж/К. Используя эти данные, определить удельную теплоту парообразования Q воды.
10.42.Определить приращение энтропии ΔS при нагревании 2,5 кг воды от t1 = 20° С до t2 = 100° С и последующем превращении воды в пар при температуре 100° С. Удельная теплота преобразования воды γ = 2,25 МДж/кг.
10.43.Кусок льда массой m = 0,5 кг, взятый при температуре t1 = 0° С, был расплавлен, после чего образовавшаяся вода была нагрета до температуры t2 = 20° С. Определить приращение энтропии ΔS.
10.44.Кусок льда массой 2,5 кг, взятый при температуре t1 = 0° С, был расплавлен при той же температуре с помощью водяного пара, имеющего температуру t2 = 100 °С. Определить массу m2 израсходованного пара и приращение энтропии ΔS системы лед–пар при таянии льда. Удельная теплота парообразования воды Q = 2,25 МДж/кг.
10.45.В калориметр, содержащий воду массой m1 = 0,25 кг при температуре t1 = 27° С, бросают лед m2 = 28 г при температуре t2 = 0° С. Определить приращение энтропии ΔS к моменту установления температуры системы. Теплоемкостью калориметра пренебречь.
10.46.В калориметр, содержащий m1 = 0,25 кг воды при температуре t1 = 17° С, опускают m2 = 0,20 кг меди при температуре t2 = 100° С. Определить изменение энтропии ΔS при выравнивании температур. Теплоемкостью калориметра пренебречь.
10.47.Приращение энтропии при плавлении 1 моля льда ΔS = 22 Дж/К. Найти приращение температуры ΔT плавления льда при повышении внешнего давления на Δр = 100 кПа. Удельные объемы воды и льда соответственно равны Vож = 1·10-3 м3/кг и Vол = 1,09·10-3 м3/кг.
10.48.Вода массой m = 0,98 кг нагревается от t1 = 0° С до t2 = 100° С и при температуре t2 полностью превращается в пар. Найти приращение энтропии ΔS системы, считая пар идеальным газом.
10.49.Лед массой m = 4,5 кг с начальной температурой t1 = 0° С в результате нагревания превращается сначала в воду, а затем в пар при температуре t2 = 100° С. Найти приращение энтропии ΔS системы, считая пар идеальным газом.
10.50.Один моль воды, находящийся в равновесии с пренебрежимо малым количеством своего насыщенного пара при температуре T1 полностью превращается в насыщенный пар при температуре Т2. Найти приращение энтропии ΔS системы. Зависимостью удельной теплоты парообразования Q воды от температуры и удельным объемом жидкости по сравнению с удельным объемом пара пренебречь. Пар рассматривать как идеальный газ.
ПРИЛОЖЕНИЯ
1. Основные физические постоянные (округленные значения)
| Физическая постоянная | Обозначение | Числовое значение |
| Нормальное ускорение свободного падения | g | 9,81 м/c2 |
| Гравитационная постоянная | G | 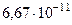 м3/(кг м3/(кг  с)2 с)2 |
| Постоянная Авогадро | NA | 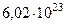 моль-1 моль-1 |
| Молярная газовая постоянная | R | 8,31 Дж/(моль  К) К) |
| Постоянная Больцмана | k | 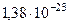 Дж/К Дж/К |
| Объем одного моля идеального газа при нормальных условиях (T0 = 273,15 К, p0 = 101325 Па) | V0 | 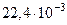 м3/моль м3/моль |
| Элементарный заряд | е | 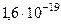 Кл Кл |
| Масса покоя электрона | me | 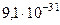 кг кг |
| Постоянная Фарадея | F | 9,65 Кл/моль |
| Скорость света в вакууме | с | 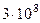 м/с м/с |
| Постоянная Стефана — Больцмана | 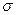 | 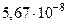 Вт/(м2 Вт/(м2  К4) К4) |
| Постоянная Вина в первом законе (смещения) | b1 | 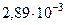 м м  К К |
| Постоянная Вина во втором законе | b2 | 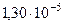 Вт/(м3 Вт/(м3  К5) К5) |
| Постоянная Планка | h | 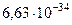 Дж Дж  с с |
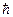 | 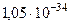 Дж Дж  с с | |
| Постоянная Ридберга | R | 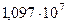 м-1 м-1 |
| Боровский радиус | r | 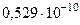 м м |
| Комптоновская длина волны электрона | 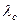 | 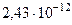 м м |
| Энергия ионизации атома водорода | Еi | 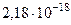 Дж = 13,6 эВ Дж = 13,6 эВ |
| Атомная единица массы | а. e. м. | 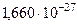 кг кг |
| Энергия, соответствующая 1 а. е. м. | 931,50 МэВ | |
| Электрическая постоянная | 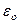 | 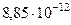 Ф/м Ф/м |
| Магнитная постоянная | 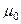 | 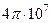 Гн/м Гн/м |
| Магнетон Бора | 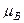 | 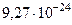 Дж/Тл Дж/Тл |
| Ядерный магнетон | 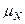 | 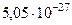 Дж/Тл Дж/Тл |
2. Некоторые астрономические величины
| Радиус Земли (среднее значение) | 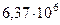 м м |
| Масса Земли | 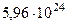 кг кг |
| Радиус Солнца (среднее значение) | 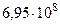 м м |
| Масса Солнца | 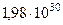 кг кг |
| Радиус Луны (среднее значение) | 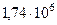 м м |
| Масса Луны | 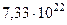 кг кг |
| Среднее расстояние между центрами Земли и Луны | 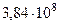 м м |
| Среднее расстояние между центрами Солнца и Земли | 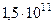 м м |
| Период обращения Луны вокруг Земли | 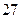 сут 7 ч 43 мин сут 7 ч 43 мин |
3. Плотность некоторых веществ
| Вещество | |||||
| Жидкость | r, 103 кг/м3 | Газ | r, 10-3 кг/м3 | Твердое тело | r, 103 кг/м3 |
| Бензол | 0,88 | Азот | 1,25 | Алюминий | 2,7 |
| Вода (при 4 °С) | 1,0 | Аммиак | 0,77 | Вольфрам | 19,75 |
| Глицерин | 1,26 | Аргон | 1,78 | Железо (сталь) | 7,85 |
| Керосин | 0,8 | Водород | 0,09 | Константин | 8,9 |
| Масло | 0,9 | Воздух | 1,29 | Лед | 0,92 |
| Ртуть | 13,6 | Гелий | 0,18 | Медь | 8,9 |
| Спирт | 0,79 | Кислород | 1,43 | Никель | 8,8 |
| Тяжелая вода | 1,1 | Метан | 0,72 | Нихром | 8,4 |
| Эфир | 0,72 | Хлор | 3,21 | Фарфор | 2,3 |
4. Удельная теплоемкость с, 103 Дж/(кг  К)
К)
| Вода | 4,19 | Лед | 2,10 | Нихром | 0,22 | Свинец | 0,126 |
5. Масса m0 и энергия Е0 покоя некоторых элементарных частиц и легких ядер
| Частицы | m0 | Е0 | ||
| а. е. м. | 10-27, кг | МэВ | 10-10, Дж | |
| Электрон | 5,486  10-4 10-4 | 0,00091 | 0,511 | 0,00081 |
| Протон | 1,00728 | 1,6724 | 938,23 | 1,50 |
| Нейтрон | 1,00867 | 1,6748 | 939,53 | 1,51 |
| Дейтрон | 2,01355 | 3,3325 | 1876,5 | 3,00 |
| a-частица | 4,0015 | 6,6444 | 3726,2 | 5,96 |
6. Множители и приставки для образования десятичных кратных и дольных единиц и их наименовании
| Приставка | множитель | Приставка | множитель | ||
| наименование | обозначение | наименование | обозначение | ||
| экса | Э | 1018 | санти | с | 10-2 |
| пета | П | 1015 | милли | м | 10-3 |
| тера | Т | 1012 | микро | мк | 10-6 |
| гига | Г | 109 | нано | н | 10-9 |
| мега | М | 106 | пико | п | 10-12 |
| кило | к | 103 | фемта | ф | 10-15 |
| деци | д | 102 | атто | а | 10-18 |
Числовые значения физических величин, которыми приходится оперировать при решении задач, являются большей частью приближенными. Точность задания числа зависит от того, сколько в нем значащих цифр. Значащими цифрами числа называются все цифры, кроме нулей слева и нулей справа, полученных округлением числа. Пример: в числе 0,00405 три значащих цифры. В нормальной форме это число запишется так: 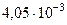 , где 4,05 – мантисса числа, а
, где 4,05 – мантисса числа, а 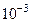 - порядок.
- порядок.
Для математических операций с приближенными числами справедливы следующие правила:
1) При сложении (вычитании) результат округляют так, чтобы он не содержал значащих цифр в тех разрядах, начиная с наибольшего, которые отсутствуют хотя бы в одном из слагаемых.
Например: 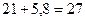 . Результат округляем до разряда единиц, так как в числе 21 нет значащих цифр начиная с разряда десятых.
. Результат округляем до разряда единиц, так как в числе 21 нет значащих цифр начиная с разряда десятых.
2) При умножении (делении) в результате оставляют столько значащих цифр, сколько их во множителе с наименьшим количеством значащих цифр.
Например: 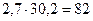 . В результате оставляем две значащих цифры – столько, сколько их во множителе 2,7.
. В результате оставляем две значащих цифры – столько, сколько их во множителе 2,7.
3) При возведении в степень (извлечении корня) в результате оставляют столько значащих цифр, сколько их в основании степени (подкоренном выражении).
Например: 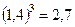 ,
, 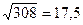 .
.
4) При вычислении сложных выражений соблюдаются правила в зависимости от вида производимых действий.
Например: 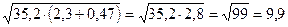
Иногда при вычислениях в выражении встречается верное число (например, при нахождении среднего значения N измерений, число N - верное). Количество значащих цифр в результате определяется только точностью приближенных чисел, поскольку в верном числе сколько угодно значащих цифр.
Например: 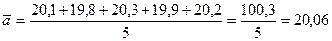
ЛИТЕРАТУРА
1. Трофимова Т.Н. Курс физики.- М.: ВШ, 2010.
2. Детлаф А.А., Яворский Б.М. Курс физики. – М.: Издательский центр «Академия», 2010.
3. Сивухин Д.В. Общий курс физики. - М.: Наука, 1979-1989, т. I-V.
4. Савельев И.В. Курс общей физики,- М: Наука, 1982-1984, т. 1-3.
5. Иродов И.Е. Задачи по общей физике.-М.: Наука, 1987.
6. Савельев И.В. Сборник вопросов и задач по общей физике.-М.: Наука, 1982.
7. Козел С.М., Рашба Э.И., Славатинский С.А. Сборник задач по физике. М.: Наука, 1987.
8. Белолипецкий, С.Н. Задачник по физике: методический материал/ Белолипецкий С.Н., Еркович О.С., Казаковцева В.А., Цвецинская Т.С., ред. Еркович О.С.— Электрон. текстовые данные.— М.: Физматлит, 2012.— 368 c.— Режим доступа: https://www.iprbookshop.ru/17245.— ЭБС «IPRbooks», по паролю
9. Козлов, В.Ф. Курс общей физики в задачах: учебное пособие/ Козлов В.Ф., Маношкин Ю.В., Миллер А.Б., Петров Ю.В.— Электрон. текстовые данные.— М.: Физматлит, 2010.— 264 c.— Режим доступа: https://www.iprbookshop.ru/12945.— ЭБС «IPRbooks», по паролю
 2015-02-14
2015-02-14 2124
2124