ФГБОУ ВО
“ВОРОНЕЖСКий ГОСУДАРСТВЕННый университет инженерных технологий
И ВАРИАНТЫ КОНТРОЛЬНЫХ РАБОТ
по дисциплинам
ХИМИЯ, НЕОРГАНИЧЕСКАЯ ХИМИЯ
для бакалавров заочной формы обучения
направления обучения: 18.03.01, 18.03.02, 15.03.04, 09.03.02, 19.03.04, 19.03.03, 19.03.02, 27.03.01, 15.03.02
Авторы: С.И.Нифталиев, И.В.Кузнецова

 |
ВОРОНЕЖ
Инструкция к выполнению контрольных работ
Перед выполнением контрольных работ внимательно изучите литературу, вам предлагаемую. Номер варианта соответствует двум последним цифрам в зачетной книжке. Контрольная работа выполняется в отдельной тетради с полями. Номера и условия задач переписываются в порядке, указанном в контрольной работе. При выполнении заданий используйте таблицы приложений, а также таблицу растворимости и периодическую систему элементов. Работы подписываются студентом с указанием специальности и своего шифра и сдается преподавателю (в деканат ФБО) для рецензирования. Если работа зачтена с замечаниями, то неверно решенные задачи исправляются студентом в этой же тетради на чистых листах.
ВАРИАНТЫ КОНТРОЛЬНЫХ РАБОТ
Номер варианта определяется двумя последними цифрами в номере зачетной книжки студента-заочника
| Номер варианта | Номер контр. работы | Номера задач, относящихся к данному варианту |
| I II III | 1, 21, 41, 81, 101, 141,171, 191, 211, 231, 251, 271, 311 61,121, 291, 321,331, 351, 371, 391, 411, 431, 451, 471,491 70,130,300, 330, 340, 360, 380, 400, 420, 440, 460, 480,500 | |
| I II III | 2, 22, 42, 82, 102, 142,172, 192, 212, 232, 252, 272, 312 62,122, 292, 322, 332,352, 372, 392,412, 432, 452, 472, 492 71, 131,301, 331, 341, 361,381,401, 421, 441, 461, 481, 501 | |
| I II III | 3, 23, 43, 83, 103, 143,173, 193, 213, 233, 253, 273, 313 63, 123, 293, 323, 333, 353, 373,393,413, 433, 453, 473,493 72,132,302,332, 342, 362, 382, 402, 422, 442, 462, 482, 502 | |
| I II III | 4, 24, 44, 84, 104, 144, 174, 194, 214, 234, 254, 274, 314 64,124,294, 324, 334, 354, 374, 394, 414, 434, 454, 474,494 73,133,303,333, 343, 363, 383, 403, 423, 443, 463, 483, 503 | |
| I II III | 5, 25, 45, 85, 105, 145,175, 195, 215, 235, 255, 275, 315 65,125,295,325, 335, 355, 375, 395, 415, 435, 455, 475, 495 74,134,304, 334, 344,364, 384, 404, 424, 444, 464, 484, 504 | |
| I II III | 6, 26, 46, 86, 106, 146 176, 196, 216, 236, 256, 276, 316 66,126,296,326, 336, 356, 376, 396, 416, 436, 456, 476, 496 75,135,305,335, 345, 365, 385, 405, 425, 445, 465, 485, 505 | |
| I II III | 7, 27, 47, 87, 107, 147, 177, 197, 217, 237, 257, 277, 317 67,127,297,327, 337, 357, 377, 397, 417, 437, 457, 477, 497 76,136,306, 336, 346, 366, 386, 406, 426, 446, 466, 486,506 | |
| I II III | 8, 28, 48, 88, 108, 148,178, 198, 218, 238, 258, 278, 318 68,128,298, 328, 338, 358, 378, 398, 418, 438, 458, 478,498 267, 287, 307, 327,337, 367,387, 407,427,447,467, 487, 500 | |
| I II III | 9, 29, 49, 89, 109, 149, 179, 199, 219, 239, 259, 279, 319 69,129,299,329, 339, 359, 379, 399, 419, 439, 459, 479, 499 269,289,309,329,339,369,389, 409, 429, 449, 469, 489,502 | |
| I II III | 10, 30, 50, 90, 110, 150, 180, 200, 220, 240, 260, 280, 320 70, 130,300,330, 340, 360, 380, 400, 420, 440, 460, 480,500 270, 290,310,330,340,370,390,410, 430, 450, 470, 490, 504 | |
| I II III | 11, 31, 51, 91, 111, 151, 181, 201, 221, 241, 261, 281, 321 71,131,301,331, 341, 361, 381, 401, 421, 441, 461, 481, 501 251,272,293,334,345,356, 377, 398, 420, 440, 460, 491, 503 | |
| I II III | 12, 32, 52, 92, 112, 152, 156, 182, 202, 222, 242, 262, 282, 72,132,302,332, 342, 362, 382, 402, 422, 442, 462, 482, 502 259,280,301,322,333, 364, 385, 406, 427, 448, 469, 489,508 | |
| I II III | 13, 33, 53, 93, 113, 153, 157, 183, 203, 223, 243, 263, 283 73,133,303,333, 343, 363, 383, 403, 423, 443, 463, 483, 503 262,283,304,325,336, 367, 388, 409, 430, 431, 472, 492,509 | |
| I II III | 14, 34, 54, 94, 114, 154, 184, 204, 224, 244, 264, 284, 324 74,134,304, 334, 344,364, 384, 404, 424, 444, 464, 484, 504 263,284,305,326,337, 368, 389, 410, 411, 432, 452, 493,510 | |
| I II III | 15, 35, 55, 95, 115, 155, 185, 205, 225, 245, 265, 285, 325 75,135,305,335, 345, 365, 385, 405, 425, 445, 465, 485, 505 268, 289,310,331,342,353,374, 395, 416, 437, 457, 498,512 | |
| I II III | 16, 36, 56, 96, 116, 156, 186, 206, 226, 246, 266, 286, 326 76,136,306, 336, 346, 366, 386, 406, 426, 446, 466, 486,506 269,290,291,332,343,354, 375, 396, 417, 438, 458, 499,513 | |
| I II III | 17, 37, 57, 77, 97, 117, 137, 157, 161, 187, 207, 227, 247 267, 287, 307, 327, 337, 367, 387, 407, 427, 447, 467, 487 264,285,306,327,338,369, 390, 391, 412, 433, 453, 494, 511 | |
| I II III | 18, 38, 58, 78, 98, 118, 138, 158, 162, 188, 208, 228, 248 268, 288, 308, 328, 338, 368, 388, 408, 428, 448, 468, 488 265,286,307,329,339, 370, 371, 392, 413, 434, 454, 495,514 | |
| I II III | 19, 39, 59, 79, 99, 119, 139, 159, 163, 189, 209, 229, 249 269, 289, 309, 329, 339, 369, 389, 409, 429, 449, 469, 489 271, 286,301,333,336,366,386, 406, 426, 446, 466, 507,520 | |
| I II III | 20, 40, 60, 80, 100, 120, 140, 160, 164, 190, 210, 230, 250 270, 290, 310, 330, 340, 370, 390, 410, 430, 450, 470, 490 251,276,302,331,342, 352, 383, 400, 412, 442, 462, 472,519 | |
| I II III | 1, 22, 43, 64, 85, 106, 127, 148, 153, 180, 201, 222, 243 252, 273, 294, 315, 336, 357, 378, 399, 420, 441, 462, 483 261, 275, 295, 314,323,334,361,395, 409, 423, 463, 510,518 | |
| I II III | 2, 23, 44, 65, 86, 107, 128, 149, 154, 181, 202, 223, 244 253, 274, 295, 316, 337, 358, 379, 400, 421, 442, 463, 484 260,281,302,323,334, 365, 386, 407, 428, 449, 470, 490,517 | |
| I II III | 3, 24, 45, 66, 87, 108, 129, 150, 155, 182, 203, 224, 245 254, 275, 296, 317, 338, 359, 380, 401, 422, 443, 464, 485 266, 282,307,329,347,362, 382, 403, 421, 442, 464, 503,516 | |
| I II III | 4, 25, 46, 67, 88, 109, 130, 151, 156, 183, 204, 225, 246 255, 276, 297, 318, 339, 360, 381, 402, 423, 444, 465, 486 263,277,297,316,325,336, 367, 397, 411, 425, 465, 508,515 | |
| I II III | 5, 26, 47, 68, 89, 110, 131, 152, 157, 184, 205, 226, 247 256, 277, 298, 319, 330, 361, 382, 403, 424, 445, 466, 487 72,132,302,332, 342, 362, 382, 402, 422, 442, 462, 482, 502 | |
| I II III | 6, 27, 48, 69, 90, 111, 132, 153, 158, 185, 206, 227, 248 257, 278, 299, 320, 331, 362, 383, 404, 425, 446, 467, 487 264,271,298,317,326, 337, 370, 398, 412, 426, 466, 507,514 | |
| I II III | 7, 28, 49, 70, 91, 112, 133, 154, 159, 186, 207, 228, 249 258, 279, 300, 321, 332, 363, 384, 405, 426, 447, 468, 488 266, 273, 300, 319, 328, 339, 374, 400, 414, 438, 505,514 | |
| I II III | 8, 29, 50, 71, 92, 113, 134, 155, 160, 187, 208, 229, 250 259, 280, 301, 322, 333, 364, 385, 406, 427, 448, 469, 489 269,289,309,329,339,369,389, 409, 429, 449, 468, 489,508 | |
| I II III | 9, 30, 51, 72, 93, 114, 135, 156, 161, 188, 209, 230, 249 260, 281, 302, 323, 334, 365, 386, 407, 428, 449, 470, 490 264,271,298,317,326, 337, 370, 398, 412, 426, 466, 507,515 | |
| I II III | 10, 31, 52, 73, 94, 115, 136, 157, 162, 189, 210, 211, 248 261, 282, 303, 324, 335, 366, 387, 408, 429, 450, 471, 491 274,134,304,334,344,364, 384, 404, 424, 444, 464, 484, 504 | |
| I II III | 11, 32, 53, 74, 95, 116, 137, 158, 163, 190, 191, 212, 247 262, 283, 304, 325, 336, 367, 388, 409, 430, 431, 472, 492 265, 273, 300, 319, 328, 339, 374, 400, 414, 438, 505,514 | |
| I II III | 12, 33, 54, 75, 96, 117, 138, 159, 164, 171, 192, 213, 246 263, 284, 305, 326, 337, 368, 389, 410, 411, 432, 452, 493 256,288,307,339, 347,355, 376, 388, 417, 435, 456, 517,520 | |
| I II III | 13, 34, 55, 76, 97, 118, 139, 160, 165, 172, 193, 214, 245 264, 285, 306, 327, 338, 369, 390, 391, 412, 433, 453, 494 269,289,309,329,339,370,389, 409, 429, 449, 468, 489,508 | |
| I II III | 14, 35, 56, 77, 98, 119, 140, 161, 166, 173, 194, 215, 246 265, 286, 307, 328, 339, 370, 371, 392, 413, 434, 454, 495 264, 271, 298,317,326,337,371, 398, 412, 426, 466, 507,514 | |
| I II III | 15, 36, 57, 78, 99, 120, 121, 162, 167, 174, 195, 216, 247 266, 287, 308, 329, 340, 351, 372, 393, 414, 435, 455, 496 274,134,304,334,344,364, 384, 404, 424, 444, 464, 484, 504 | |
| I II III | 16, 37, 58, 79, 100, 101, 122, 163, 168, 175, 196, 217, 248 267, 288, 309, 330, 341, 352, 373, 394, 415, 436, 456, 497 | |
| I II III | 17, 38, 59, 80, 82, 102, 123, 164, 169, 176, 197, 218, 249 268, 289, 310, 331, 342, 353, 374, 395, 416, 437, 457, 498 266,282,307,329,347, 362, 382, 403, 421, 442, 464, 503,516 | |
| I II III | 18, 39, 60, 63, 83, 103, 124, 165, 170, 177, 198, 219, 250 269, 290, 291, 332, 343, 354, 375, 396, 417, 438, 458, 499 263, 277,297,316,325,336,367, 397, 411, 425, 465, 508,516 | |
| I II III | 19, 40, 43, 64, 84, 104, 125, 141, 166, 178, 199, 220, 234 270, 273, 292, 333, 344, 355, 376, 397, 418, 439, 459, 500 72,132,302,332, 342, 362, 382, 402, 422, 442, 462, 482, 502 | |
| I II III | 20, 23, 45, 67, 88, 109, 130, 147, 168, 189, 210, 221, 242 251, 272, 293, 334, 345, 356, 377, 398, 420, 440, 460, 501 263,277,297,316,325,336, 367, 397, 411, 425, 465, 508,515 | |
| I II III | 2, 24, 46, 68, 89, 110, 131, 148, 170, 190, 201, 223, 241 265, 281, 306, 328, 346, 361, 380, 402, 422, 441, 461, 502 266, 273, 300, 319, 328, 339, 374, 400, 414, 438, 505,514 | |
| I II III | 3, 25, 47, 69, 90, 111, 132, 149, 169, 171, 202, 224, 242 266, 282, 307, 329, 347, 362, 382, 403, 421, 442, 464, 503 269,289,309,330,339,370,389, 409, 429, 449, 468, 489,508 | |
| I II III | 4, 26, 48, 70, 91, 112, 133, 150, 170, 172, 192, 225, 243 267, 283, 308, 330, 348, 363, 383, 401, 423, 443, 463, 504 274,134,304,334,344,364, 384, 404, 424, 444, 464, 484, 509 | |
| I II III | 5, 27, 49, 71, 92, 113, 134, 151, 154, 173, 193, 226, 244 268, 284, 309, 331, 349, 364, 384, 404, 424, 444, 464, 505 264,271,298,317,326, 337, 370, 398, 412, 426, 466, 507,514 | |
| I II III | 6, 28, 50, 72, 93, 114, 135, 152, 155, 174, 194, 227, 245 269, 285, 310, 332, 350, 365, 385, 405, 425, 445, 465, 506 263,277,297,316,325, 336, 367, 397, 411, 426, 465, 508,515 | |
| I II III | 7, 29, 51, 73, 94, 115, 136, 153, 156, 175, 195, 228, 246 270, 286, 301, 333, 336, 366, 386, 406, 426, 446, 466, 507 374,134,304,334, 344,364,384, 404, 424, 444, 464, 484, 504 | |
| I II III | 8, 30, 52, 74, 95, 116, 137, 154, 157, 176, 196, 229, 247 252, 271, 302, 334, 337, 367, 387, 407, 427, 447, 467, 508 263,277,297,316,325,336, 369, 397, 411, 425, 465, 508,515 | |
| I II III | 9, 31, 53, 75, 96, 117, 138, 155, 158, 177, 197, 230, 248 253, 272, 303, 335, 338, 368, 388, 408, 428, 448, 468, 509 266, 273, 300, 319, 328, 339, 374, 400, 414, 438, 505,514 | |
| I II III | 10, 32, 54, 76, 97, 118, 139, 156, 159, 178, 198, 211, 231 254, 273, 304, 336, 339, 369, 389, 409, 429, 449, 469, 510 268,284,309,331,349, 364, 384, 404, 424, 444, 464, 505,512 | |
| I II III | 11, 33, 55, 77, 98, 119, 140, 157, 160, 179, 199, 212, 232 255, 274, 305, 337, 340, 370, 390, 410, 430, 450, 470, 511 251,272,293,334,345, 356, 377, 398, 420, 440, 460, 501,520 | |
| I II III | 12, 34, 56, 78, 99, 120, 122, 158, 161, 180, 200, 213, 233 251, 275, 291, 316, 321, 351, 391, 411, 431, 451, 471, 512 264,271,298,317,326, 337, 370, 398, 412, 426, 466, 507,514 | |
| I II III | 13, 35, 57, 79, 100, 103, 121, 159, 162, 182, 201, 214, 234 252, 276, 292, 317, 325, 352, 392, 412, 432, 452, 472, 513 266,282,307,329,347, 362, 382, 403, 421, 442, 464, 503,516 | |
| I II III | 14, 36, 58, 80, 85, 104, 123, 160, 163, 183, 202, 215, 235 253, 277, 293, 318, 324, 353, 393, 413, 433, 453, 473, 514 72,132,302,332, 342, 362, 382, 402, 422, 442, 462, 482, 502 | |
| I II III | 15, 37, 59, 61, 84, 105, 124, 141, 162, 184, 203, 216, 236 254, 278, 294, 319, 323, 354, 374, 394, 414, 434, 474, 515 263,277,297,316,325,336, 367, 397, 411, 425, 465, 508,515 | |
| I II III | 16, 38, 60, 62, 83, 106, 125, 143, 163, 185, 204, 217, 237 255, 279, 295, 320, 322, 355, 375, 395, 415, 435, 455, 516 251,272,293,334,345, 356, 377, 398, 420, 440, 460, 501,520 | |
| I II III | 17, 33, 41, 63, 82, 101, 126, 142, 164, 186, 205, 217, 238 256, 280, 296, 321, 346, 356, 376, 396, 426, 436, 456, 517 266, 273, 300, 319, 328, 339, 374, 400, 414, 438, 505,514 | |
| I II III | 18, 40, 42, 61, 81, 102, 127, 144, 165, 187, 206, 218, 239 257, 271, 297, 326, 347, 357, 377, 397, 427, 437, 457, 518 269,289,309,330,339,370,389, 409, 429, 449, 468, 489,508 | |
| I II III | 19, 21, 43, 62, 87, 103, 128, 145, 166, 188, 207, 219, 240 258, 272, 298, 327, 348, 358, 378, 398, 428, 438, 458, 519 268,284,309,331,349, 364, 384, 404, 424, 444, 464, 505,520 | |
| I II III | 20, 22, 41, 63, 88, 104, 129, 146, 167, 189, 208, 220, 241 259, 273, 299, 328, 349, 359, 379, 399, 423, 439, 459, 520 263,277,297,316,325, 336, 367, 397, 411, 425, 465, 508,515 | |
| I II III | 1, 24, 42, 64, 89, 105, 130, 147, 168, 190, 209, 230, 242 260, 274, 300, 329, 350, 360, 380, 400, 424, 440, 460, 470 264,271,298,317,326, 337, 370, 398, 412, 426, 466, 507,514 | |
| I II III | 3, 25, 43, 65, 90, 106, 131, 148, 169, 171, 201, 213, 250 270, 275, 301, 330, 331, 351, 382, 391, 411, 441, 461, 471 251,272,293,334,345, 356, 377, 398, 420, 440, 460, 501,520 | |
| I II III | 4, 26, 44, 66, 91, 107, 132, 149, 170, 178, 192, 212, 238 251, 276, 302, 331, 342, 352, 383, 400, 412, 442, 462, 472 263, 277,297,316, 325,336,367, 397, 411, 425, 465, 508,516 | |
| I II III | 5, 27, 45, 67, 92, 108, 133, 150, 157, 174, 193, 224, 239 252, 277, 303, 332, 343, 353, 384, 391, 413, 433, 463, 473 268,284,309,331,349, 364, 385, 404, 424, 444, 464, 505,520 | |
| I II III | 6, 28, 46, 68, 93, 109, 134, 151, 158, 172, 194, 223, 240 253, 278, 304, 333, 344, 354, 385, 392, 414, 434, 464, 474 259,271,310,332,350, 351, 380, 391, 420, 439, 459, 514,519 | |
| I II III | 7, 29, 47, 69, 94, 110, 135, 152, 159, 173, 195, 225, 241 254, 279, 305, 334, 345, 355, 386, 393, 415, 435, 465, 475 264,271,298,317,326, 337, 370, 398, 412, 426, 466, 507,514 | |
| I II III | 8, 30, 48, 70, 95, 111, 136, 153, 160, 174, 196, 226, 242 255, 280, 306, 335, 346, 356, 387, 394, 416, 436, 466, 476 72,132,302,332, 342, 362, 382, 402, 422, 442, 462, 482, 502 | |
| I II III | 9, 31, 49, 71, 96, 112, 137, 154, 161, 173, 197, 227, 243 256, 287, 307, 336, 347, 357, 388, 395, 417, 437, 467, 477 263,277,297,316,325,336, 367, 397, 411, 425, 465, 508,515 | |
| I II III | 10, 32, 50, 72, 97, 113, 138, 155, 162, 176, 198, 228, 243 257, 288, 308, 337, 348, 358, 389, 396, 418, 438, 468, 478 266, 273, 300, 319, 328, 339, 374, 400, 414, 436, 505,514 | |
| I II III | 11, 33, 51, 73, 98, 114, 139, 156, 163, 177, 199, 229, 244 258, 289, 309, 338, 349, 359, 390, 397, 419, 438, 469, 479 269,290,308,330,339,370,389, 409, 429, 449, 468, 489,508 | |
| I II III | 12, 34, 52, 74, 99, 115, 140, 157, 164, 178, 200, 230, 245 259, 290, 310, 339, 350, 360, 381, 398, 420, 439, 470, 489 264,271,298,317,326, 337, 370, 399, 412, 426, 466, 507,519 | |
| I II III | 13, 35, 53, 75, 100, 116, 121, 158, 165, 179, 201, 211, 231 260, 271, 291, 311, 330, 341, 361, 399, 411, 471, 480, 520 268, 284,309,331,349,364, 384, 404, 424, 444, 464, 505,519 | |
| I II III | 14, 36, 54, 76, 86, 117, 122, 159, 166, 180, 182, 202, 212 266, 288, 308, 321, 342, 362, 371, 398, 414, 444, 451, 455 259,271,310,332,350, 351, 380, 391, 420, 439, 459, 514,519 | |
| I II III | 15, 37, 55, 77, 85, 118, 123, 160, 162, 183, 203, 213, 233 267, 289, 293, 313, 322, 343, 363, 372, 403, 422, 445, 452 269,279,309,330,339,370,389, 409, 429, 449, 468, 489,508 | |
| I II III | 16, 38, 56, 78, 84, 119, 124, 142, 161, 184, 204, 214, 234 268, 290, 294, 314, 323, 344, 364, 373, 393, 423, 446, 453 263,277,297,316,325, 336, 367, 397, 411, 425, 465, 508,515 | |
| I II III | 17, 39, 57, 79, 83, 120, 125, 141, 163, 185, 205, 215, 235 269, 271, 295, 315, 324, 345, 365, 374, 405, 424, 447, 454 268,284,309,331,349, 364, 384, 404, 423, 444, 464, 505,520 | |
| I II III | 18, 40, 58, 80, 82, 101, 126, 143, 164, 186, 206, 216, 236 270, 271, 296, 316, 325, 346, 366, 375, 397, 425, 448, 455 251,272,293,334,345, 356, 377, 398, 420, 440, 460, 501,517 | |
| I II III | 19, 23, 59, 61, 81, 102, 127, 144, 165, 187, 207, 217, 237 251, 271, 297, 317, 326, 347, 367, 376, 398, 426, 449, 456 264,272,298,318,325, 337, 370, 398, 412, 420, 466, 507,518 | |
| I II III | 20, 21, 60, 62, 100, 103, 128, 145, 166, 188, 208, 218, 238 252, 272, 298, 318, 327, 348, 368, 399, 427, 450, 457, 464 259,271,310,332,350, 351, 380, 391, 420, 439, 459, 514,519 | |
| I II III | 4, 22, 51, 63, 99, 104, 129, 146, 167, 189, 209, 229, 250 253, 273, 300, 319, 328, 349, 369, 390, 400, 428, 431, 465 260,281,302,323,334, 365, 386, 407, 428, 449, 470, 490,517 | |
| I II III | 5, 23, 52, 64, 98, 105, 130, 147, 168, 190, 210, 230, 239 254, 274, 281, 310, 320, 329, 350, 370, 381, 410, 429, 432 266, 273, 300, 319, 328, 339, 374, 400, 414, 438, 505,517 | |
| I II III | 6, 24, 53, 65, 97, 106, 131, 148, 169, 191, 211, 231, 250 255, 275, 282, 301, 330, 341, 351, 371, 411, 430, 450, 457 268,284,309,331,349, 364, 384, 404, 424, 444, 464, 505,520 | |
| I II III | 7, 25, 54, 66, 96, 107, 132, 149, 170, 171, 192, 212, 232 251, 276, 283, 302, 334, 342, 372, 383, 389, 412, 431, 451 259,271,310,332,350, 351, 380, 391, 420, 439, 459, 514,519 | |
| I II III | 8, 26, 55, 67, 95, 108, 133, 150, 165, 172, 193, 213, 233 252, 277, 303, 335, 343, 351, 384, 390, 391, 413, 432, 452 266,282,307,329,347, 362, 382, 403, 421, 442, 464, 503,516 | |
| I II III | 9, 27, 56, 68, 94, 109, 134, 151, 166, 171, 194, 214, 234 253, 278, 304, 336, 344, 352, 374, 385, 414, 433, 453, 520 264,271,298,317,326, 337, 370, 398, 412, 426, 466, 507,514 | |
| I II III | 10, 28, 57, 69, 93, 110, 135, 152, 166, 172, 195, 215, 235 254, 279, 305, 337, 345, 353, 375, 386, 415, 434, 454, 519 259,271,310,332,350, 351, 380, 391, 420, 439, 459, 514,518 | |
| I II III | 11, 29, 58, 70, 92, 111, 136, 153, 167, 173, 196, 216, 236 255, 280, 306, 338, 346, 354, 377, 387, 416, 436, 455, 518 263,277,297,316,325, 336, 367, 397, 411, 425, 465, 508,515 | |
| I II III | 12, 30, 59, 71, 91, 112, 137, 154, 168, 175, 197, 217, 237 256, 288, 307, 339, 347, 355, 376, 388, 417, 435, 456, 517 251,272,293,334,345,356, 377, 398, 420, 440, 460, 501,520 | |
| I II III | 13, 31, 60, 72, 90, 113, 138, 155, 169, 176, 198, 218, 238 257, 289, 308, 330, 348, 356, 378, 389, 418, 437, 457, 516 266, 273, 300, 319, 328, 339, 374, 400, 414, 438, 505,517 | |
| I II III | 14, 32, 41, 73, 89, 114, 139, 156, 170, 177, 199, 219, 239 258, 290, 309, 331, 349, 357, 379, 390, 419, 438, 458, 515 253, 273,300,319,328,349, 369, 391, 400, 428, 431, 465,514 | |
| I II III | 15, 33, 42, 74, 88, 115, 140, 157, 169, 178, 200, 220, 240 259, 271, 310, 332, 350, 351, 380, 391, 420, 439, 459, 514 268, 284, 309,331,349,364,384, 404, 424, 444, 464, 505,520 | |
| I II III | 16, 34, 43, 75, 87, 116, 131, 158, 169, 181, 201, 221, 241 260, 272, 292, 311, 333, 331, 355, 392, 406, 440, 460, 513 259,271,310,332,350, 351, 380, 391, 420, 439, 459, 514,519 | |
| I II III | 17, 35, 44, 76, 86, 117, 132, 159, 168, 180, 202, 222, 241 269, 273, 293, 312, 321, 332, 357, 393, 407, 421, 461, 512 260,281,302,323,334, 365, 386, 407, 428, 449, 470, 490,517 | |
| I II III | 18, 36, 45, 77, 85, 118, 133, 160, 161, 183, 203, 223, 242 270, 274, 294, 313, 322, 333, 359, 394, 408, 422, 462, 511 269,289,309,330,339,370,389, 409, 429, 449, 468, 489,508 | |
| I II III | 19, 37, 46, 78, 84, 119, 134, 141, 162, 184, 204, 224, 243 261, 275, 295, 314, 323, 334, 361, 395, 409, 423, 463, 510 259,271,310,332,350, 351, 380, 391, 420, 439, 459, 514,519 | |
| I II III | 20, 38, 47, 79, 83, 120, 135, 142, 163, 185, 205, 225, 244 262, 276, 296, 315, 324, 335, 365, 396, 410, 424, 464, 509 260,281,302,323,334, 365, 386, 407, 428, 449, 470, 490,517 | |
| I II III | 1, 39, 48, 80, 82, 110, 136, 143, 164, 186, 206, 226, 245 263, 277, 297, 316, 325, 336, 367, 397, 411, 425, 465, 508 256, 288, 307, 339, 347, 355, 376, 388, 417, 435, 456, 517 | |
| I II III | 2, 40, 49, 61, 81, 111, 137, 144, 165, 187, 207, 227, 246 264, 271, 298, 317, 326, 337, 370, 398, 412, 426, 466, 507 251,272, 293,334,345,356, 378, 399, 420, 440, 460, 501,520 | |
| I II III | 3, 24, 50, 62, 100, 112, 138, 145, 166, 188, 208, 228, 247 265, 272, 299, 318, 327, 338, 351, 373, 399, 413, 433, 506 268,284,309,331, 349,364, 384, 404, 424, 444, 464, 505,520 | |
| I II III | 4, 25, 51, 63, 99, 113, 139, 146, 167, 189, 209, 229, 248 266, 273, 300, 319, 328, 339, 374, 400, 414, 438, 505 269,289,309,330,340,370,389, 409, 429, 449, 468, 489,508 | |
| I II III | 5, 26, 52, 64, 98, 114, 140, 147, 168, 190, 210, 230, 249 267, 274, 291, 320, 329, 353, 375, 381, 415, 440, 464, 504 265,282,307,329,347, 362, 382, 403, 421, 442, 464, 503,516 |
1. Какой объем займет смесь, состоящая из 0,5 моль азота и 0,25 моль хлора при нормальных условиях? Какова масса этой смеси?
2. Относительная плотность газа по воздуху равна 0,59. Содержание в нем азота 82,35 %, водорода 17,65 %. Выведите молекулярную формулу газа.
3. Объем смеси водорода с хлором равен 0,05 дм3. После образования хлороводорода осталось 0,01 дм3 хлора. Вычислите массовые доли водорода и хлора в смеси.
4. При анализе некоторого вещества, содержащего серу, из образца массой 14,4 · 10-3 кг получили 23,3 · 10-3 кг сульфата бария. Вычислите массовую долю серы в исследуемом веществе.
5. При обработке 19 · 10-3 кг смеси карбоната и гидрокарбоната натрия соляной кислотой выделилось 5,06 дм3 газа при температуре 27 °С и давлении 98658,28 Па. Вычислите количество вещества карбоната и гидрокарбоната натрия в исходной смеси (моль).
6. В закрытом баллоне находится 0,2 кг кислорода под давлением 354,64 · 103 Па при температуре 7 °С. Вычислите массу углекислого газа в таком же объеме при той же температуре и давлении 283,71 · 103 Па.
7. Вычислите молекулярную массу газа, 0,8 дм3 которого при 17 °С и 103,99 · 103 Па имеет массу 2 · 10-3 кг.
8. Определите давление 5 кг азота в баллоне вместимостью 40 дм3 при температуре 7 °С.
9. Вычислите температуру, при которой 1 дм3 оксида углерода (II) при нормальном давлении имеет массу 10-3 кг.
10. При растворении в серной кислоте 10-2 кг сплава цинка с магнием выделилось 5,2 дм3 водорода, измеренного при 26 °С и давлении 122,656 · 103 Па. Вычислите массовые доли металлов в сплаве.
11. Вычислите объем 0,32 кг оксида серы (IV) при давлении 415,43 · 103 Па и температуре 27 °С.
12. Каков объем 3 · 10-3 кг паров воды при температуре 103 °С и давлении 101,325 · 103 Па.
13. Какой объем при температуре 21 °С и давлении 101,99 · 103 Па займет водород, необходимый для превращения 8,3 · 10-3 кг оксида никеля (III) в металлический никель?
14. Найдите объемный состав смеси кислорода с азотом, плотность которой по водороду равна 14,6.
15. Какой объем воздуха необходим для полного сгорания 1 м3 газовой смеси, имеющей объемные доли: 50 водорода, 40 оксида углерода (II), 5 углекислого газа и 5 азота?
16. Некоторый газ массой 5,6 · 10-3 кг занимает объем 4,84 дм3 при температуре 17 °С и давлении 0,997 · 105 Па. Чему равна относительные молекулярная и молярная массы этого газа?
17. Какую плотность по водороду и воздуху имеет газовая смесь, состоящая из азота, водорода и аммиака, если объемные доли этих газов соответственно равны 30, 10 и 60.
18. Чему равна относительная молекулярная масса вещества, если 1,3 · 10-3 кг этого вещества в парообразном состоянии занимает объем 0,6 дм3 при температуре 87 °С и давлении 0,83 · 105 Па?
19. Какой объем при температуре 27 °С и давлении 105 Па занимает газ массой 10-3 кг, если его плотность по водороду равна 32?
20. Некоторое вещество в парообразном состоянии объемом 16,4 дм3 при температуре 127 °С и давлении 97 · 103 Па имеет массу, равную 36,95 · 10-3 кг. Чему равна относительная молекулярная масса этого вещества?
21. При растворении в воде 1,6 · 10-3 кг металла выделилось 0,896 дм3 водорода (условия нормальные). Вычислите молярную массу эквивалента этого металла.
22. Для нейтрализации 1,89 · 10-3 кг кислоты израсходовано 1,68 · 10-3 кг гидроксида калия. Вычислите молярную массу эквивалента кислоты.
23. При растворении в разбавленной серной кислоте 1,68 · 10-3 кг металла образовалось 4,56 · 10-3 кг его сульфата. Вычислите молярную массу эквивалента этого металла.
24. При обработке 5,64 · 10-3 кг нитрата металла серной кислотой образовалось 4,8 · 10-3 кг его сульфата. Вычислите молярную массу эквивалента металла.
25. При разложении 15 · 10-3 кг карбоната металла образовалось 8,4 · 10-3 кг его оксида. Вычислите молярную массу эквивалента металла.
26. При сжигании 0,24 × 10-3 кг металла в закрытом сосуде с воздухом образовался оксид металла. Объем газа, приведенного к нормальным условиям, уменьшился на 112 × 10-3 дм3. Вычислите молярную массу эквивалента металла.
27. Для полного восстановления 16 × 10-3 кг оксида металла потребовалось 4,78 дм3 водорода, взятого при температуре 7 °С и давлении 97,325 кПа. Вычислите молярную массу эквивалента металла.
28. Вычислите молярную массу эквивалента металла, 10-3 кг оксида которого при растворении в серной кислоте дает 3×10-3 кг сульфата.
29. Из 5,7 · 10-3 кг сульфата металла получено 2,6 · 10-3 кг его гидроксида. Какова молярная масса эквивалента этого металла?
30. Вычислите молярную массу эквивалента металла, для восстановления 3,4 · 10-3 кг оксида которого потребовалось столько водорода, сколько его выделяется в ходе реакции 6,5 · 10-3 кг цинка с кислотой.
31. Одно и тоже количество металла соединяется с 0,4 × 10-3 кг кислорода и 3,995 · 10-3 кг галогена. Назовите этот галоген.
32. При пропускании сероводорода раствор, содержащий 5,21 × 10-3 кг сульфата некоторого металла, образуется 3,61 × 10-3 кг его сульфида. Какова молярная масса эквивалента этого металла?
33. 0,3 × 10-3 кг металла вытесняют из соляной кислоты 0,28 дм3 водорода, измеренного при нормальных условиях. 0,5 × 10-3 кг этого же металла вытесняют 4,5 × 10-3 кг серебра из растворов его солей. Вычислите молярную массу эквивалента серебра.
34. 2,043 × 10-3 кг металла вытесняют из кислоты 0,7 дм3 водорода. Это же количество металла вытесняет 6,475 × 10-3 кг свинца из растворов его солей. Какова молярная масса эквивалента свинца?
35. Вычислите молярную массу эквивалента металла, из 2 × 10-3 кг гидроксида которого можно получить 3,74 × 10-3 кг его сульфата.
36. Какое количество эквивалента вещества карбоната натрия надо взять для того, чтобы из раствора перевести в осадок 0,5 моль ионов кальция?
37. Чему равны молярные массы эквивалентов ортофосфорной кислоты в реакциях с гидроксидом натрия, которые приводят к образованию:
а) дигидрофосфата натрия;
б) гидрофосфата натрия;
в) ортофосфата натрия?
38. Чему равны молярные массы эквивалента гидроксида железа (III) в реакциях с серной кислотой, идущих с образованием:
а) дигидроксосульфата железа (III);
б) гидроксосульфата железа (III);
в) сульфата железа (III).
39. Вычислите, какие значения может иметь молярная масса эквивалента сульфата алюминия в реакциях с гидроксидом натрия, если количества вещества соли и щелочи относятся как:
а) 1 моль: 2 моль; б) 1 моль: 4 моль.
40. Чему равны молярные массы эквивалента сульфата цинка в реакциях со щелочью, идущие с образованием:
а) гидроксида цинка,
б) гидроксосульфата цинка,
в) тетрагидроксоцинката натрия?
41. Какой из элементов, имеющих валентное электронное строение 4s23d3 или 4s24p3, обладает окислительными свойствами? Почему?
42. Дайте характеристику с помощью 4-х квантовых чисел 3-го электрона в атоме бора. Охарактеризовать этот элемент с точки зрения его положения в периодической системе.
43. Составьте электронные формулы для атомов элементов с порядковыми номерами 25 и 34. К какому электронному типу относится каждый из них? Охарактеризуйте каждый из элементов с точки зрения их положения в периодической системе элементов.
44. Какими правилами определяется порядок заполнения электронами подуровней в атоме? Приведите электронные конфигурации невозбужденных атомов Br; Mn; Ti и ионов Ba2+; Fe3+.
45. Почему у марганца преобладают металлические свойства, тогда как расположенные в той же группе галогены – типичные неметаллы.
46. Среди приведенных ниже электронных конфигураций укажите невозможные и объясните причину невозможности их реализации:
а) 1p3; б) 3p6; в) 3s2; г) 12s3; д) 2d5; е) 5d2; ж) 3f12.
47. На какой, из приведенных ниже орбиталей электрон обладает меньшей энергией? Ответ мотивируйте соответствующим правилом.
а) 6s; б) 6p; в) 4f; г) 5d.
48. Какие из элементов II периода не могут проявлять высшую валентность, равную номеру группы? Ответ обоснуйте.
49. По каким формулам можно подсчитать:
а) количество орбиталей в уровне;
б) число орбиталей на подуровне;
в) число электронов на данном подуровне?
50. Запишите электронные формулы атомов элементов с зарядом ядра:
а) +8; б) +13; в) +18; г) +23; д) +53; е) +63.
Составьте графические схемы заполнения электронами валентных орбиталей этих атомов.
51. Напишите электронные формулы атомов йода и титана. К какому семейству элементов они относятся?
52. Напишите электронные формулы атомов хрома, меди и германия. К какому семейству элементов они относятся?
53. Напишите электронно-графические формулы атомов индия, германия и титана в нормальном и возбужденном состоянии.
54. Исходя из порядка заполнения энергетических состояний (уровней и подуровней) электронами у атомов элементов седьмого периода предскажите электронную формулу 117-го элемента и опишите его свойства на основе строения его атома.
55. Опишите свойства 43-го элемента согласно строению его атома. Каков состав и свойства его оксидов и гидроксидов?
56. Опишите свойства элемента, состав и свойства его оксидов и гидроксидов, если валентные электроны расположены на 5d46s2 подуровнях.
57. Напишите состав гидроксидов элементов, имеющих на внешнем уровне s2p4-электроны. Как изменяются кислотные свойства этих гидроксидов с увеличением порядковых номеров этих элементов?
58. Наружный электронный слой атомов элементов выражается формулами …3s23p6 …3d54s2. Определите порядковый номер и название каждого из этих элементов.
59. Составьте электронные формулы для атомов элементов с порядковыми номерами 24 и 46.
60. Руководствуясь Периодической системой, укажите символ химического элемента, атому которого отвечает следующая электронная формула:
а) 1s22s22p63s23p6; б) 1s22s22p63s23p63d104s2.
Укажите валентные энергетические подуровни в приведенных электронных формулах атомов.
61. В каком периоде находятся все 5d - элементы? Назовите их. Напишите электронную формулу первого из них.
62. Как изменяется сила кислородсодержащих кислот элементов VI группы главной подгруппы от серной до теллуровой кислоты? Ответ обоснуйте.
63. Как изменяются свойства гидроксидов хрома при повышении степени окисления хрома? Приведите примеры реакций, доказывающих кислотно-основные свойства гидроксидов хрома.
64. Какой из элементов обладает более выраженными восстановительными свойствами: 6s2; 6s25d1; 6s25d2; 6s26p2. Ответ обоснуйте.
65. Как меняется характер высших оксидов и гидроксидов у элементов одного периода с увеличением порядкового номера элемента? Приведите составы высших гидроксидов элементов 3-го периода.
66. Как по электронному строению различаются элементы главных и побочных подгрупп? Что объединяет элементы главных и побочных подгрупп в одну группу?
67. На чем основано деление всех элементов на металлы и неметаллы? В чем условность этого деления?
68. Какой гидроксид является более сильным основанием: Ca(OH)2 или Ba(OH)2? Какой гидроксид является более сильной кислотой: Si(OH)4 или Ge(OH)4? Ответы мотивируйте.
69. Элементы какой группы (и подгруппы) проявляют в своих соединениях степень окисления, равную -3. Назовите эти элементы и приведите примеры таких соединений.
70. Что такое сродство элемента к электрону? Как изменяется эта величина по периоду и главным подгруппам с увеличением заряда ядра?
71. Что такое электроотрицательность? Как она изменяется по периоду с увеличением заряда ядра элемента?
72. Что такое энергия ионизации? Как она меняется в главной и побочной подгруппах?
73. Как изменяются атомные радиусы с увеличением зарядов ядер элементов? Почему?
74. Перечислите электронные аналоги среди элементов VI группы периодической системы элементов. Напишите в общем виде электронные формулы валентных электронных подуровней атомов этих элементов.
75. Пользуясь периодической системой, дайте мотивированный ответ на вопрос: какой из двух гидроксидов является более сильным основанием: Sr(OH)2 или Ba(OH)2; Sr(OH)2 или Cd(OH)2; Ca(OH)2 или Fe(OH)2.
76. Как влияет повышение степени окисления элемента на свойства образуемых им гидроокисей? Исходя из этого, ответьте на вопрос: какая из двух гидроокисей является более сильным основанием: CuOH или Cu(OH)2; TlOH или Tl(OH)3; Fe(OH)2 или Fe(OH)3?
77. Как изменяются металлические свойства элементов в главных подгруппах с увеличением их атомных масс? На основании этого сделайте вывод о закономерности изменения прочности водородных соединений в рядах
а) NH3, PH3, AsH3, SbH3, BiH3;
б) HI, HBr, HCl, HF.
78. Сколько элементов включают в себя лантаноиды и актиноиды? Почему? Чем можно объяснить близость свойств элементов в каждой из этих групп? Почему наиболее устойчивой степенью окисления для лантаноидов является +3?
79. Чем можно объяснить, что большинство свойств элементов изменяются периодически. Как изменяются радиусы атомов в периодах и группах? Что называется d- и f-сжатием? Разберите на примере s- и d-элементов первой группы периодической системы.
80. Какие элементы пятого периода периодической системы имеют высший оксид ЭО2? Какой из этих элементов образует газообразные соединения с водородом? Составьте формулы орто- и метакислот, образуемых этими элементами, и изобразите их графически.
81. Объясните донорно-акцепторный механизм образования ковалентной связи на примере образования иона фосфония РН4+.
82. Какая связь – полярная или неполярная имеет место в молекулах СО, СО2, HBr, Br2? Представьте геометрические модели этих молекул.
83. Напишите электронные конфигурации основных и возбужденных состояний атомов хлора, фосфора, бора, углерода, кобальта.
84. Каково пространственное строение молекул CF4, CH4, PH3? Ответ поясните.
85. Существует ли аналогия в строении молекул H2O и H2; PH3 и NH3; CO и HCl? Ответ обоснуйте.
86. Изобразите перекрывание электронных орбиталей в молекулах: F2, HF, H2S, PH3. Какова геометрическая форма таких молекул?
87. Какую ковалентную связь называют s – связью и какую p – cвязью? Ответ подтверите на примере конкретных молекул.
88. Что такое sp –, sp2 –, sp3 – гибридизация атомных орбиталей? Приведите примеры молекул, при образовании которых происходит такого вида гибридизация. Какова структура этих молекул?
89. Определите тип химической связи между атомами в молекулах СН4 и H2S. Какова структура этих молекул? В какой из них наблюдается гибридизация атомных орбиталей?
90. Какие электроны атома бора участвуют в образовании ковалентных связей? Как метод валентных связей объясняет симметричную треугольную форму молекул BF3?
91. Определите тип химической связи между атомами в молекулах H2O, BeCl2. Какова структура этих молекул? Какая из них имеет дипольный момент, равный нулю. Почему? Наблюдается ли в какой-нибудь из этих молекул гибридизация атомных орбиталей.
92. Опишите с позиций метода ВС электронное строение молекулы BF3 и иона BF4-.
93. Какой атом или ион служит донором электронной пары при образовании иона: а) BH4-; б) NH4+?
94. Руководствуясь разностью относительных электроотрицательностей связи Э-О, определите, как меняется характер связи в оксидах элементов третьего периода периодической системы Д.И.Менделеева.
95. Вычислите разницу относительных электроотрицательностей следующих пар атомов: H-S; H-N; H-Ge; H-K. Какая из этих связей наиболее полярна?
96. Определите наличие донорно-акцепторной связи в молекуле H[BF4] и объясните механизм ее образования.
97. Как образуются химические связи в молекулах NH3 и BCl3? Какова структура этих молекул? Полярны ли связи B-Cl и полярна ли молекула BCl3?
98. В каких молекулах имеются p – связи: C2H4; C2H2; CH4; O2; H2O? Приведите схемы перекрывания электронных облаков в этих молекулах.
99. Сравнить кратности связей и магнитные свойства молекулы В2 и молекулярного иона В2+.
100. Какие силы молекулярного взаимодействия называются ориентационными, индукционными и дисперсионными? Когда возникают и какова природа этих сил?
101. От каких факторов зависит скорость химической реакции? Как изменится скорость реакции взаимодействия хлорида железа (III) с роданидом калия в растворе вследствие разбавления смеси водой вдвое?
102. От каких факторов зависит константа скорости? Определите константу скорости реакции:
2А + В = С,
если при концентрациях А и В, равных 0,5 и 0,6 моль/дм3, соответственно, ее скорость составляет 0,018 моль/(дм3×мин).
103. Что понимают под скоростью химической реакции? Чему равна скорость химической реакции, если концентрация одного из реагирующих веществ в начальный момент была равна 1,2 моль/дм3, а через 50 мин стала 0,3 моль/дм3?
104. Как изменится скорость реакции синтеза аммиака, если концентрацию азота увеличить в 3 раза, а водорода – в 5 раз? Как повлияет на выход аммиака увеличение температуры, если DН этой реакции < 0?
105. Сформулируйте правило Вант-Гоффа. Во сколько раз увеличится скорость реакции, если увеличить температуру от -10 до +30 °С? (При повышении температуры на 10°С скорость этой реакции увеличивается в 3 раза).
106. Скорость реакции при некоторой температуре равна: 5,84 × 10-4 моль/дм3×мин. Начальная концентрация одного из реагирующих веществ равна 0,02 моль/дм3. Определите концентрацию этого вещества через 25 мин после начала реакции. Как изменится при этом константа скорости?
107. Почему скорость реакции увеличивается с увеличением температуры? Определите температурный коэффициент реакции, если при повышении температуры на 40 °С скорость реакции возросла в 16 раз?
108. Реакция протекает по уравнению:
2NO + O2 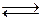 2NO2.
2NO2.
Исходная концентрация с(NO) = 0,6 моль/дм3, c(O2) = = 0,3 моль/дм3. Константа скорости равна 0,5. Вычислите скорость реакции в начальный момент; как изменится скорость и константа скорости, если увеличить концентрацию О2?
109. Реакция протекает в водном растворе по уравнению:
Na2S2O3 + H2SO4 = Na2SO4 + S + H2SO3.
Как изменится скорость реакции, если реагирующую смесь разбавить водой в 4 раза?
110. При повышении температуры от 30 °С до 70 °С скорость реакции возросла в 81 раз. Во сколько раз она возрастет при увеличении температуры от 70 °С до 80 °С?
111. В системе:
CO + Cl2 ® COCl2,
концентрацию СО увеличили от 0,3 до 1,2 моль/дм3, а концентрацию хлора – в 3 раза. Во сколько раз увеличилась скорость реакции? Как при этом изменилась константа скорости?
112. Рассчитайте начальную скорость гомогенной реакции
А + 2В = АВ2,
если с(А) = с(В) = 0,4 моль/дм3, а константа скорости равна 2×10-3. Как изменится скорость реакции, если концентрации реагирующих веществ увеличить на 0,1 моль/дм3?
113. Сформулируйте правило Вант-Гоффа. На сколько градусов необходимо повысить температуру, чтобы скорость реакции увеличилась в 16 раз, если температурный коэффициент реакции равен 2?
114. Во сколько раз следует увеличить концентрацию оксида углерода в системе:
2СО = СО2 + С,
чтобы скорость реакции увеличилась в четыре раза?
115. Во сколько раз следует увеличить давление, чтобы скорость образования NO2 по реакции
2NO + O2 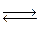 2NO2
2NO2
возросла в 1000 раз?
116. Напишите уравнение скорости реакции
С + О2 = СО2
и определите, во сколько раз увеличится скорость реакции при увеличении концентрации кислорода в три раза.
117. Реакция между оксидом азота (II) и хлором протекает по уравнению:
2NO + Cl2 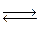 2NOCl.
2NOCl.
Как изменится скорость реакции при увеличении:
а) концентрации оксида азота в два раза;
б) концентрации хлора в два раза;
в) концентрации обоих веществ в два раза?
118. На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 30 раз (г=2,5)?
119. При повышении температуры на 50 0С скорость реакции возросла в 1200 раз. Вычислите температурный коэффициент реакции.
120. Реакция идет по уравнению:
N2 + 3H2 = 2NH3.
Концентрации участвующих в ней веществ были: с(N2) = = 0,80 моль/дм3; с(H2) = 1,5 моль/дм3; с(NH3) = 0,10 моль/дм3. Вычислите концентрацию водорода и аммиака, когда с(N2) стала равной 0,50 моль/дм3.
121. Равновесные концентрации в системе
СО + Сl2 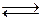 COCl2
COCl2
равны: c(CO) = c(Cl2) = 0,3 моль/дм3, c(COCl2) = 1,5 моль/дм3. Вычислите начальную концентрацию хлора и константу равновесия. Какими изменениями концентраций и давления можно сместить равновесие в сторону обратной реакции.
122. Реакция протекает по схеме:
A + B 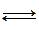 C + D.
C + D.
Исходные концентрации веществ таковы: c(A) = c(B) = = c(C) = c(D) = 1 моль/дм3. Вычислите константу равновесия, если концентрация вещества D в момент равновесия равна 1,5 моль/дм3. Сформулируйте принцип Ле-Шателье.
123. От каких факторов зависит константа равновесия? При некоторой температуре константа равновесия термической диссоциации
N2O4 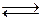 2NO2
2NO2
равна 0,26. Равновесная концентрация с(NO2) = 0,28 моль/дм3. Какая доля N2O4 (в % по массе) продиссоциировала к моменту равновесия?
124. Реакция протекает по схеме
N2 + H2 = NH3.
В начальный момент реакции с(N2) = 1,5 моль/дм3, c(H2) = = 2,5 моль/дм3. Каковы концентрации азота и водорода, при концентрации аммиака с(NH3) = 0,5 моль/дм3?
125. При повышении температуры увеличивается степень превращения йодоводорода в водород и йод. Какой является эта реакция, экзо- или эндотермической? Напишите выражения для константы равновесия для этой обратимой реакции.
126. Реакция протекает по уравнению:
4HCl + O2 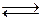 2Cl2 + 2H2O.
2Cl2 + 2H2O.
Исходная концентрация хлороводорода с(HCl) = 0,4 моль/дм3, кислорода с(О2) = 0,2 моль/дм3. К моменту равновесия прореагировало 50 % HCl. Вычислите константу равновесия.
127. Равновесные концентрации в системе
2SO2 + O2 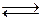 2SO3
2SO3
равны: c(SO2) = 0,008 моль/дм3, c(O2) = 0,824 моль/дм3, c(SO3) = 0,032 моль/дм3. Определите исходную концентрацию оксида серы (IV). Как следует изменить концентрацию диоксида серы и давление, чтобы сместить равновесие в сторону обратной реакции?
128. Образование хлороводорода из простых веществ – процесс экзотермический. В какую сторону сместится равновесие:
а) при увеличении температуры;
б) при уменьшении давления?
129. Реакция протекает по схеме:
PCl5 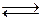 PCl3 + Cl2.
PCl3 + Cl2.
Исходное количество PСl5 равно 2 моль. К моменту наступления равновесия разложилась половина пентахлорида фосфора. Каково общее количество всех веществ (моль) в системе в момент равновесия?
130. Выведите выражение для константы равновесия и рассчитайте ее величину для процесса разложения молекулярного хлора на атомы, если исходная концентрация хлора 0,04 моль/дм3, а в момент достижения равновесия концентрация Cl2 уменьшилась на 2 · 10-3 моль/дм3.
131. При некоторой температуре константа равновесия системы:
3H2 + N2 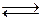 2NH3
2NH3
равна 0,1. Равновесная концентрация аммиака с(NH3) = = 0,08 моль/дм3, водорода с(Н2) = 0,2 моль/дм3. Рассчитайте равновесную и исходную концентрации азота. Как и почему повлияет на смещение равновесия в этой системе повышение давления?
132. Сформулируйте принцип Ле-Шателье. Вычислите константу равновесия и исходную концентрацию кислорода в системе
2NO + O2 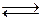 2NO2,
2NO2,
если равновесные концентрации веществ равны: c(NO) = = 0,6 моль/дм3, c(O2) = 0,3 моль/дм3, c(NO2) = 0,4 моль/дм3.
133. Как и почему влияет катализатор на скорость химической реакции и на смещение химического равновесия в гомогенной системе?
134. Равновесие в системе
2NO + O2 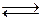 2NO2
2NO2
установилось при следующих концентрациях: c(O2) = = 1,6 моль/дм3, c(NO) = 0,06 моль/дм3, c(NO2) = 0,24 моль/дм3. Рассчитайте константу равновесия. Почему повышение давления в этой системе увеличивает выход оксида азота (IV)?
135. Напишите выражение для константы равновесия системы:
C(тв) + О2(г) 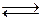 СО2(г), DH < 0.
СО2(г), DH < 0.
Какие внешние воздействия вызовут смещение равновесия вправо?
136. Хлороводород является экзотермическим соединением. Как влияет на выход хлороводорода при его синтезе из простых веществ:
а) повышение температуры;
б) повышение давления.
137. Исходная концентрация азота с(N2) = 2 моль/дм3, водорода с(Н2) = 7 моль/дм3. Равновесная концентрация азота с(N2) = = 1,8 моль/дм3. Вычислите равновесную концентрацию аммиака в системе:
3H2 + N2 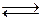 2NH3.
2NH3.
138. Напишите выражение для константы равновесия гомогенной системы:
СН4 + СО2 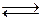 2СО + 2Н2.
2СО + 2Н2.
Как следует изменить температуру и давление, чтобы повысить выход водорода? Прямая реакция – образования водорода эндотермическая.
139. Напишите выражение для константы равновесия гетерогенной системы:
СО2 + С 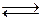 2СО.
2СО.
Как изменится скорость прямой реакции – образования СО, если концентрацию СО2 уменьшить в четыре раза? Как следует изменить давление, чтобы повысить выход СО?
140. Напишите выражение для константы равновесия гетерогенной системы:
С + Н2О(г) 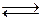 СО + Н2.
СО + Н2.
Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции – образования водяных паров?
141. Определите массовую долю гидроксида натрия в растворе, полученном растворением 4,5 г натрия в 1 дм3 воды.
142. Какой объем (дм3) раствора с массовой долей хлорида натрия 9 % и плотностью 1,05 г/см3 можно приготовить, имея 300 см3 воды?
143. При выпаривании 200 г раствора с массовой долей некоторого вещества 10 % выпало в осадок 10 г вещества. Масса раствора после выпаривания – 60 г. Чему равна массовая доля растворенного вещества в растворе после выпаривания?
144. Какая масса (г) воды необходима для растворения 50 г Na2CO3, чтобы получить раствор с массовой долей карбоната натрия 8 %?
145. Из 100 г раствора с массовой долей KNO3 40 % выпариванием удалили 50 г воды. Вычислите массовую долю нитрата калия в полученном растворе.
146. Смешали 400 г раствора с массовой долей Na2HPO4 8 % и 300 г раствора с массовой долей этой же соли 5 %. Вычислите массовую долю гидрофосфата натрия в полученном растворе.
147. Массовая доля Na2SO4 в 5 дм3 водного раствора (r = 1,15 г/см3) равна 7 %. Рассчитайте мольную долю сульфата натрия в данном растворе.
148. Вычислите мольные доли NaCl и воды в 3 дм3 раствора (r = 1,041 г/см3) с массовой долей NaCl 6 %.
149. Вычислите мольные доли H2SO4 и воды в растворе с массовой долей серной кислоты 15 %.
150. В 90 г воды растворено 13,68 г сахара. Вычислите мольную долю растворителя в этом растворе.
151. Вычислите мольные доли KOH и воды в 5 моль/дм3 растворе гидроксида калия (r = 1,220 г/см3).
152. В 3 дм3 раствора содержится 2,5 моль гидроксида натрия. Вычислите титр раствора.
153. Вычислите массовую концентрацию (титр) раствора с молярной концентрацией эквивалента хлорида натрия 0,04 моль/дм3.
154. Вычислите массовую концентрацию (титр) 0,5 моль/дм3 раствора азотной кислоты.
155. Определите молярность раствора соляной кислоты (r = = 1,18 г/см3), в котором массовая доля HСl составляет 36,2 %.
156. Чему равна молярность раствора (r = 1,07 г/см3) в котором массовая доля гидроксида калия составляет 8 %?
157. Какую массу технического гидроксида натрия, содержащего 10 % воды, необходимо взять для приготовления 900 см3 0,5 моль/дм3 раствора NaOH?
158. Какую массу раствора, в котором массовая доля КОН составляет 12 %, надо взять, чтобы получить раствор объемом 250 см3 молярной концентрации 2 моль/дм3?
159. Растворы одного и того же вещества молярной концентрации 1 моль/дм3; 2 моль/дм3 и 0,2 моль/дм3 смешаны в объемных отношениях 1: 2: 7. Определите молярную концентрацию полученного раствора.
160. Рассчитайте моляльность раствора с массовой долей гидроксида калия 10 % (r = 1,090 г/см3).
161. Какую массу сахарозы надо взять для приготовления раствора массой 200 г, моляльность которого равна 0,05 моль/кг?
162. Рассчитайте моляльность раствора, приготовленного из глюкозы массой 9 г и воды объемом 500 см3.
163. Рассчитайте моляльность раствора с массовой долей H3PO4 20 % (r = 1,1 г/см3).
164. Какая масса кристаллической соды Na2CO3 · 10H2O требуется для приготовления раствора объемом 1,2 дм3 с молярной концентрацией эквивалента, равной 0,2 моль/дм3?
165. Какой объем одномолярного раствора серной кислоты требуется для приготовления 500 см3 раствора серной кислоты с молярной концентрацией эквивалента 0,5 моль/дм3?
166. Какой из растворов серной кислоты более концентрированный: c молярной концентрацией эквивалента 18 моль/дм3 или раствор с массовой долей вещества 50 % (r = 1,4 г/см3)?
167. Смешаны два раствора с молярной концентрацией эквивалента 0,5 и 2 моль/дм3, взятые объемом, соответсвенно 2 и 0,5 дм3. Чему равна молярная концентрация эквивалента вещества в полученном растворе?
168. В растворе объемом 250 см3 содержится сульфат алюминия массой 7,8 г. Чему равна молярная концентрация эквивалента соли в этом растворе?
169. Какой объем 0,1 моль/дм3 раствора хлорида алюминия необходимо взять для приготовления 1 дм3 раствора с молярной концентрацией эквивалента 0,15 моль/дм3.
170. Для нейтрализации 40 см3 раствора серной кислоты потребовалось прибавить к ним 24 см3 раствора щелочи с молярной концентрацией эквивалента 0,2 моль/дм3. Определите молярную концентрацию эквивалента взятого раствора серной кислоты.
171. Рассчитайте осмотическое давление раствора неэлектролита содержащего 1,62 · 1023 молекул этого вещества в 0,3 дм3 раствора при 35 °С.
172. К 200 см3 0,3 моль/дм3 водного раствора сахарозы (С12Н22О11) добавили 10 г С12Н22О11. Вычислите осмотическое давление полученного раствора при 298 К.
173. Вычислите осмотическое давление водного раствора, содержащего в 1 дм3 18,5 г глюкозы (С6Н12О6) при 20 °С. Плотность раствора принять равной единице.
174. Раствор, в 0,2 дм3 которого содержится 2,8 г некоторого высокомолекулярного соединения, обладает при 298 °К осмотическим давлением равным 618,5 кПа. Определите молекулярную массу этого соединения.
175. Вычислите при 25 °С давление насыщенного пара над водным раствором с массовой долей карбамида СО(NH2)2 8 %, если давление насыщенного пара чистой воды при этой же температуре составляет 3,166 кПа.
176. Вычислите температуры кипения раствора хлорида аммония, если в 200 г воды растворено 1,27 г NH4Cl. Степень
 2015-10-22
2015-10-22 1431
1431