РАЗДЕЛ 2. МОЛЕКУЛЯРНАЯ ФИЗИКА. ТЕРМОДИНАМИКА
Основные формулы
1. Основное уравнение молекулярно-кинетической теории газов
Р = (n m0<υкв>2)/3 = (2/3)n<Wк>,
Р = nkT,
где Р – давление; n – число молекул в единице объема; m0 – масса одной молекулы газа; < υкв > – средняя квадратичная скорость молекулы; k –постоянная Больцмана; Т – абсолютная температура.
2. Концентрация молекул
n = N/V,
где N – число молекул, содержащихся в данной системе; V – объем.
3. Средняя кинетическая энергия поступательного движения молекулы
<Wк> = (3/2) kT.
4. Средняя кинетическая энергия молекулы
<W> = (i/2) kT,
где i – число степеней свободы молекулы.
5. Средняя квадратичная скорость молекулы
<υкв> = 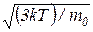 =
= 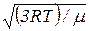 ,
,
где k – постоянная Больцмана; Т – абсолютная температура; m0 – масса молекулы; μ – молярная масса; R – универсальная газовая постоянная.
6. Средняя арифметическая скорость молекулы
<υ> = 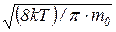 =
= 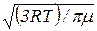 .
.
7. Наиболее вероятная скорость молекулы
υв = 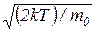 =
= 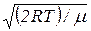 .
.
n = m/ μ = N/NA,
где m – масса вещества; μ – его молярная масса; N – число молекул; NA – число Авогадро.
9. Уравнение состояния идеального газа (уравнение Менделеева –Клапейрона)
PV = (m/μ) × RT,
где Р – давление газа в сосуде; V – объем сосуда; m – масса газа, содержащегося в данном сосуде; μ – молярная масса газа; R – универсальная газовая постоянная; Т – абсолютная температура.
10. Изотермический процесс (Т = const, m = const)
P1V1 = P2V2.
11. Изохорический процесс (V = const, m = const)
P = P0 (1+ at) или P1/P2 = T1/T2,
где t – температура по шкале Цельсия; T – температура по шкале Кельвина; a – температурный коэффициент.
12. Изобарический процесс (Р = const, m = const)
V = V0(1+ at) или V1/V2 = T1/T2.
13. Работа расширения газа:
в общем случае
A = 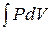 ;
;
при изобарическом процессе
A = P DV;
при изотермическом процессе
A = ν R T ln(V2/V1);
при адиабатическом процессе
A = – ν сv ΔТ,
где DV – изменение объема; R – универсальная газовая постоянная; ν – количество вещества; сv – удельная теплоемкость при постоянном объеме; DТ – изменение температуры.
14. Внутренняя энергия идеального газа
U = (ν R T)(i/2) = ν сv Т,
где i – число степеней свободы молекулы.
15. Удельные теплоемкости газа:
при постоянном объеме
сv =(i/2) (R/μ),
при постоянном давлении
ср =(i+2/2) (R/μ).
16. Уравнение Майера для удельных теплоемкостей
ср – сv = R/μ.
17. Уравнение Пуассона
(P V)γ = const,
где γ = Ср / Сv = (i + 2)/ i, Ср,Сv – молярные теплоемкости при постоянном давлении, объеме.
18. Связь между удельной (с) и молярной (С) теплоемкостями
c = С/μ.
19. Уравнение теплового баланса
Q = c m (t2 – t1),
где Q – количество теплоты, необходимое для нагревания тела массой m от температуры t1 до температуры t2; c – удельная теплоемкость вещества.
20. Теплота плавления
Q = l m,
где l – удельная теплота плавления вещества.
21. Теплота парообразования
Q = r m,
где r – удельная теплота парообразования вещества.
22. Первый закон термодинамики
Q = DU + A,
где Q – количество теплоты, сообщенное термодинамической системе; DU – изменение внутренней энергии системы; А – работа, совершенная системой против внешних сил.
23. Коэффициент полезного действия цикла Карно
h = (Q1 – Q2)/Q1 =(T1 – T2) /T1,
где Q1 – количество теплоты, полученное от нагревателя; Q2 – количество теплоты, переданное холодильнику; Т1 – абсолютная температура нагревателя; Т2 – абсолютная температура холодильника.
24. Разность энтропий двух состояний В и А
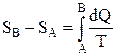 .
.
25. Закон распределения молекул по скоростям (закон Максвелла)
DN = N × f(u) × Du
f(u) = (4/ 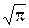 )
) 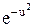 u2,
u2,
где ΔN – число молекул, относительные скорости которых лежат в интервале от u до (u + Δu); u =υ/υв – относительная скорость, где υ – данная скорость,
υв – наиболее вероятная скорость молекул; Δu – величина интервала относительных скоростей, малая по сравнению со скоростью u.
Ph= P0 e(–μgh/RT),
где Ph – давление газа на высоте h; P0 – давление на высоте h = 0; g – ускорение свободного падения.
27. Средняя длина свободного пробега молекул газа
<λ> = <υ>/<z> = 1/(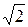 πσ2n),
πσ2n),
где < υ > – средняя арифметическая скорость; < z > – среднее число столкновений каждой молекулы с остальными в единицу времени; σ – эффективный диаметр молекулы; n – число молекул в единице объема.
28. Общее число столкновений всех молекул в единице объема за единицу времени
Z = (1/2) <z> n.
Примеры решения задач
Пример 1. Определить плотность воздуха при давлении 830 мм рт. ст. и температуре 17 °С.
 Решение. Для решения задачи необходимо перевести данные в единицы международной системы СИ. Давление воздуха равно 830 мм рт. ст. Это значит, что давление воздуха равно давлению у основания ртутного столба высотой 830 мм, а оно рассчитывается по формуле
Решение. Для решения задачи необходимо перевести данные в единицы международной системы СИ. Давление воздуха равно 830 мм рт. ст. Это значит, что давление воздуха равно давлению у основания ртутного столба высотой 830 мм, а оно рассчитывается по формуле
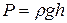 ,
,
где Р – давление; ρ – плотность жидкости; g – ускорение свободного падения; h – высота столба жидкости.
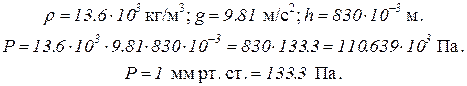
Переведем температуру в градусы Кельвина:
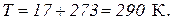
Молярная масса воздуха
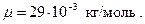
Плотность газа определяется отношением его массы к объему:
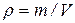 .
.
Из уравнения Менделеева – Клапейрона выразим плотность:
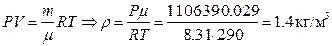 ,
,
Пример 2. В баллоне объемом 40 литров находится кислород при температуре 300 К. Когда часть кислорода израсходовали, давление в баллоне понизилось на 100 кПа. Определить массу израсходованного кислорода. Температура газа в баллоне не изменилась.
Решение. Массу израсходованного кислорода можно определить как разность масс газа до работы с баллоном и после работы с баллоном:
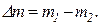
В общем виде изменение массы газа определяется по формуле
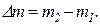
Решая последнее уравнение, мы получим Dm < 0. Это говорит о том, что масса газа в баллоне уменьшается. В предложенной задаче мы определяем убыль массы газа, а не изменение массы.
Считая кислород в баллоне идеальным газом, мы можем для описания его состояния использовать основное уравнение газового состояния – уравнение Менделеева – Клапейрона
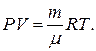
Это уравнение дает возможность выразить значения масс в начальном и конечном состояниях кислорода:
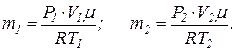
По условию задачи
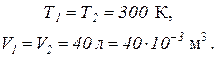
Определим убыль массы газа:
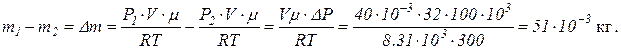
Масса израсходованного газа Dm = 0.051 кг.
Пример 3. Средняя длина свободного пробега молекулы углекислого газа при нормальных условиях равна 40 нм. Какова средняя арифметическая скорость молекул? Сколько столкновений в секунду испытывает молекула?
Решение. Средняя арифметическая скорость <u> молекул определяется по формуле
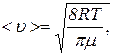
где m – масса одного киломоля газа.
Выразим числовые значения R и m в системе СИ и подставим в формулу:
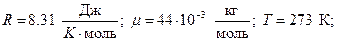
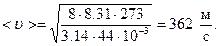
Число столкновений молекулы в секунду < z > зависит от средней скорости молекулы< u > и средней длины ее свободного пробега < l > и выражается формулой
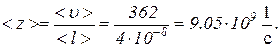
Пример 4. Какое количество теплоты поглощают 200 г водорода, нагреваясь от 0 до 100 °С при постоянном давлении? Каков прирост внутренней энергии газа? Какую работу совершает газ?
Решение. Количество теплоты Q, поглощаемое газом при изобарическом нагревании, определяется по формуле
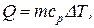
где m – масса нагреваемого газа; ср – удельная теплоемкость газа при постоянном давлении; DT – изменение температуры газа.
Как известно,
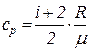 ,
,
где i – число степеней свободы молекулы газа; R – универсальная газовая постоянная; m – масса одного киломоля газа.
Подставив выражение сp в Q, получим
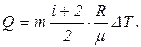
Выразим величины, входящие в эту формулу, в единицах системы СИ: m = 200 г =0.2 кг; i = 5, т. к. водород – газ двухатомный.
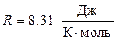 ;
;
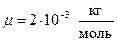 .
.
Подставим эти значения в формулу Q и произведем вычисление:
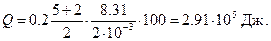
Внутренняя энергия газа выражается формулой
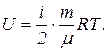
Следовательно, изменение внутренней энергии
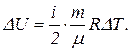
Подставив сюда числовые значения в системе СИ, получим
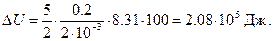
Работу расширения газа найдем по формуле, выражающей первое начало термодинамики,
Q = DU + A,
откуда
A = Q – DU.
Подставив значение Q и DU, найдем
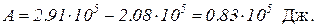
Работу, совершаемую газом, можно определить также по формуле
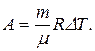
Подставив числовые значения, получим
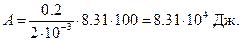
Пример 5. Нагреватель тепловой машины, работающей по циклу Карно, имеет температуру 200 °С. Какова температура охладителя, если за счет каждой килокалории тепла, полученной от нагревателя, машина совершает работу 1680 Дж. Потери на трение и теплоотдачу не учитываются.
Решение. Температуру охладителя можно найти, использовав выражение для термического КПД машины, работающей по циклу Карно,
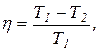
где Т1 – абсолютная температура нагревателя; Т2 – абсолютная температура охладителя.
Отсюда
Т2 = Т1 (1 – h).
Термический КПД тепловой машины есть коэффициент использования теплоты. Он выражает отношение количества теплоты, которое превращено в работу А, к количеству теплоты Q1, которое получено рабочим телом тепловой машины из внешней среды (от нагревателя), т. е.
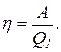
Найдем температуру охладителя
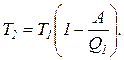
Выразим все величины в системе СИ и вычислим температуру охладителя:
Q1 = 1 ккал = = 4.19×103 Дж;
Т1 = 200 + 273 = 473 К;
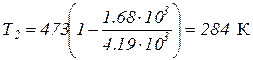 .
.
Пример 6. Найти изменение энтропии при нагревании 100 г воды от
0 до 100 °С и последующем превращении воды в пар той же температуры.
Решение. Найдем отдельно изменение энтропии 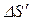 при нагревании воды и изменение энтропии
при нагревании воды и изменение энтропии 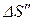 при превращении воды в пар. Полное изменение энтропии выразится суммой
при превращении воды в пар. Полное изменение энтропии выразится суммой 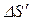 и
и 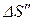 .
.
Как известно, изменение энтропии выражается общей формулой
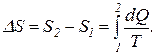
При бесконечно малом изменении dT температуры нагреваемого тела затрачивается количество теплоты
dQ = mcdT,
где m – масса тела; c – его удельная теплоемкость.
Запишем формулу для вычисления энтропии при нагревании воды:
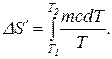
Вынеся за знак интеграла постоянные величины и произведя интегрирование, получим
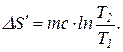
Произведем вычисления в системе СИ:
m = 100 г = 0.1 кг;
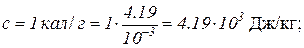
Т1=273 К;
Т2=100+273=373 К;
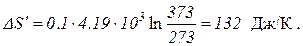
При вычислении изменения энтропии во время превращения воды в пар той же температуры постоянная температура T может быть вынесена за знак интеграла. Вычислив интеграл, получим
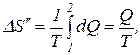
где Q – количество теплоты, переданное при превращении нагретой воды в пар той же температуры;
Q = lm,
где l – удельная теплота парообразования.
Таким образом, изменение энтропии
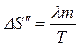 .
.
Выразим числовые значения величин в системе СИ:
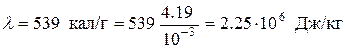 ;
;
m = 0.1 кг;
T = 373 K.
Произведем арифметические действия:
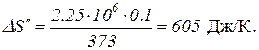
Полное изменение энтропии при нагревании воды и последующем превращении ее в пар
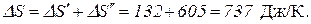
Пример 7. Какая часть молекул водорода, находящегося при температуре 400 К, обладает скоростями, отличающимися от наиболее вероятной скорости не выше чем на 5 м/с?
Решение. Распределение молекул по относительным скоростям выражается уравнением
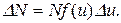
Здесь N – полное число молекул газа; f (u) – функция распределения Максвелла; u = υ/υв, где υ – данная скорость, υв – наиболее вероятная скорость.
Поскольку в задаче речь идет о наиболее вероятной скорости, надо считать υ = υв. Следовательно, u = 1 и уравнение примет более простой вид:
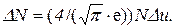
Отсюда найдем ту часть молекул, относительные скорости которых лежат в интервале Δu:
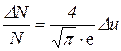 . (1)
. (1)
Прежде чем производить расчеты по (1), необходимо убедиться в том, что выполняется условие Δu<<u. Так как u = υ/υв, то
Δu = Δυ/υв. (2)
Чтобы вычислить Δu по (2), найдем сначала наиболее вероятную скорость по формуле
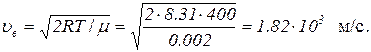
Подставив это значение в (2) и имея в виду, что Δ υ=10 м/с, поскольку в задаче идет речь о скоростях, лежащих в интервале от (υв – 5 м/с) до (υв + 5 м/с), получим Δu = 1/182.
Теперь сделаем подстановку в формулу (1):
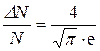 Δu=
Δu= 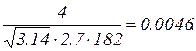
Пример 8. На какой высоте давление воздуха составляет 75 % от давления на уровне моря? Температуру считать постоянной и равной 0 °С.
Решение. Воспользуемся барометрической формулой
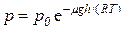 ,
,
где p – давление на высоте слоя газа h; p0 – давление на высоте h = 0; μ – молярная масса газа; T – его абсолютная температура.
Итак, по условию задачи
p = 3p0/4= p0 e–μgh/RT,
откуда
e–μgh/RT = 3/4,
–μgh/RT = ln(3/4),
следовательно,
h = (–RT ln(3/4))/(μg).
Вычислим результат:
h = (–8.31∙273∙ln(3/4))/(0.029∙9.8) = 2296.4 м.
 2015-10-22
2015-10-22 3853
3853