Рудненский индустриальный институт
Кафедра «Прикладная экология и химия»
Методические УКАЗАНИЯ К СРС
по дисциплине «Химия»
для студентов технических специальностей
Рудный 2006
ББК 20.1
Автор: Барулина И.В. Методические указания к СРС по дисциплине «Химия»– Рудный, РИИ, 2006. – 28 с.
Рецензенты: Куликова Г.Г., зав.каф.ПЭиХ, к.х.н.
Олейник А.И., зав.каф. ПГСХ, д.т.н.
Рекомендовано к изданию УМС РИИ
В методических указаниях к СРС по дисциплине «Химия» содержатся общие методические указания, методические указания для выполнения СРС-заданий, перечень вопросов и заданий к каждому занятию по СРС, рекомендуемая литература.
Методические указания предназначены для студентов технических специальностей, изучающих дисциплину в объеме 2 кредита.
Список лит. 7 назв.
для внутривузовского использования
© Рудненский индустриальный институт 2006
СОДЕРЖАНИЕ
Введение…………….…………………………………………………………………4
Тема 1 Предмет и задачи химии. Основные понятия и законы…………………….5
СРС 1 Классы неорганических соединений………………………………………….5
|
|
|
СРС 2 Основные законы химии……………………………………………………….5
Тема 2 Строение атома………………………………………………………………..6
СРС 3 Модели строения атома……………………………………………………….6
СРС 4 Квантово-механическое представление о строении атома…………………..6
СРС 5 Окислительно-восстановительные свойства атомов…………………………6
СРС 6 Метод полуреакций…………………………………………………………….7
Тема 3 Химическая связь и межмолекулярные взаимодействия…………………..7
СРС 7 Ковалентная связь……………………………………………………………..7
СРС 8 Метод молекулярных орбиталей……………………………………………..8
СРС 9 Межмолекулярные взаимодействия………………………………………….8
Тема 4 Теория комплексных соединений Вернера………………………………….8
СРС 10 Комплексные соединения…………………………………………………....8
СРС 11,12 Подготовка к коллоквиуму………………………………………………..9
Тема 5 Химическая термодинамика. …………………………………………….... 10
СРС 13 Термохимия. Закон Гесса…………………………………………………..10
СРС 14 Определение теплоты гидратации безводного сульфата меди (II)………10
СРС 15 Термодинамические законы…………………………………………………10
СРС 16 Условия самопроизвольного протекания процессов…………………….. 11
Тема 6 Химическая кинетика……………………………………………...…………11
СРС 17 Скорость химических реакций……………………………………………..11
CРC18 Решение задач по теме «Скорость химических реакций»…………………11
СРС 19 Химическое равновесие……………………………………………………..12
СРС 20 Равновесия в гетерогенных системах………………………………………12
Тема 7 Растворы и дисперсные системы……………………………………………12
|
|
|
СРС 21 Приготовление растворов заданной концентрации………………………..12
СРС 22 Дисперсные системы………………………………………………………...13
СРС 23 Растворы электролитов………………………………………………………13
СРС 24 Гидролиз солей……………………………………………………………….13
СРС 25,26 Тестирование по темам 5-7……………………………………………...14
Тема 8 Электрохимия………………………………………………………………...16
СРС 27 Гальванические элементы…………………………………………………...16
СРС 28 Коррозия металлов…………………………………………………………...16
СРС 29 Электролиз …………………………………………………………………...17
СРС 30 Химические источники тока………………………………………………...17
Вопросы для подготовки к экзамену ………………………………………………..18
Варианты заданий домашней контрольной работы..………………………………26
Список литературы……………………………………………………………………26
ВВедение
Для освоения материала по изучаемой дисциплине необходимо прорабатывать материал учебника основательно, обращая особое внимание на выводы. Если Вы испытываете трудности в усвоении материала, не сомневайтесь в своих способностях и попробуйте разобраться и понять выводы, а затем вернуться к основному тексту. По всем вопросам можно получить консультацию у преподавателя во время практических занятий и СРСП.
Весь изучаемый материал можно разделить на следующие модули: основные понятия и законы химии, строение атома и химическая связь, закономерности протекания химических реакций, электрохимия, специальные разделы химии. Изучение каждого модуля заканчивается составлением и сдачей глоссария, работать над которым нужно в течение всего времени изучения модуля. Последний срок сдачи глоссария не позднее заключительного занятия по изучаемому модулю. Правильность выполнения заданий и проработка тем проверяется на аудиторных занятиях или СРСП с проставлением баллов. Наивысший балл проставляется только в случае качественного и полного выполнения задания. При сдаче заданий не в срок вводится поправочный коэффициент 0.8. При работе с текстом нет необходимости переписывать текст с учебника методом копирования, необходимо записать лишь основные моменты, которые помогут при устном ответе на вопросы или при работе в малых группах. Необходимо научиться правильно формулировать и высказывать свои суждения по изучаемым вопросам. После проработки теоретического материала, необходимо решить задачи, тем самым подкрепив теоретические знания практическими навыками. В самостоятельную работу студента включена также подготовка к лабораторному занятию. Для этого необходимо изучить теоретические вопросы по предлагаемой литературе и лабораторному практикуму, уяснить цель и задачи каждого опыта, а также письменно составить план проведения опытов и уравнения, характеризующие каждый химический процесс.
В течение семестра будет проведено два рубежных контроля в виде коллоквиума и тестирования. Коллоквиум – устное собеседование преподавателя с каждым студентом по темам 1-4, тест включает 30 вопросов по темам 5-7. Если по тестированию правильно даны ответы на менее 50% вопросов, баллы не засчитываются, и предоставляется повторный шанс сдачи рубежного контроля.
Задания по одному из модулей можно заменить решением задач по предложенной преподавателем теме. Для этого необходимо в начале изучения темы предупредить преподавателя и получить конкретное задание.
При подготовке к СРСП необходимо прорешать задачи согласно своему варианту. Вариант решения задач указывает преподаватель, проводящий занятия по СРСП.
Тема 1 Предмет и задачи химии. Основные понятия и законы
СРС 1 Классы неорганических соединений
Цель: Повторить классификацию неорганических соединений и свойства кислот, оснований, оксидов и солей.
|
|
|
Ключевые слова: оксид, основание, кислоты, соли, амфотерные оксиды, амфотерные гидроксиды, реакции: замещения, обмена, разложения, обмена, нейтрализации.
Вопросы и задания
1. Классификация химических веществ.
2. Оксиды, классификация, свойства.
3. Кислоты, классификация, свойства.
4. Основания, классификация, свойства.
5. Соли, классификация, свойства.
Рекомендации: Проработать материал по учебнику, составить уравнения реакций, подтверждающих химические свойства неорганических веществ, сделать письменно задания по [3] глава II, подготовиться к лабораторной работе: составить план проведения опытов, записать уравнения.
Литература [3] – с.29-37, [1]- с.29-34, 242-245.
СРС 2 Основные законы химии
Цель: Повторить, углубить и осмыслить представления об основных законах химии и научиться решать задачи с применением законов химии.
Ключевые слова: атом, молекула, моль, молекулярная масса, молярная масса, молярный объем, число Авогадро, эквивалент, молярная масса эквивалентов.
Вопросы и задания
1. Закон сохранения массы вещества.
2. Закон постоянства состава вещества.
4. Закон Авогадро.
5. Закон эквивалентов. Расчет эквивалентов и молярных масс эквивалентов оксидов, гидроксидов, солей.
6. Решение задач по [3] согласно варианту, глава I.
Рекомендации: Проработать материал лекции, учебника, научиться находить молярные массы эквивалентов сложных веществ, задачи решить в тетради.
Литература [1] – с. 18-27, [2] – с.14-16, [3] – с.7-8
Тема 2 Строение атома
СРС 3 Модели строения атома
Цель: Познакомиться с развитием представлений о строении атома. Выявить преимущества и недостатки каждой модели.
Ключевые слова: электрон, радиоактивность, линейчатые спектры, альфа-частицы, квант.
Вопросы и задания
1. Открытия, доказывающие сложность строения атома.
2. Модель строения атома по Томпсону.
3. Опыты Резерфорда и модель строения атома по Резерфорду.
4. Постулаты Бора и строение атома по Бору.
Рекомендации: Проработать материал лекции, учебника, выписать преимущества и недостатки каждой модели.
|
|
|
Литература [1] – с 37-45, [2] – с.17-20.
СРС 4 Квантово-механическое представление о строении атома
Цель: Изучить принципы заполнения атомных орбиталей. Научиться составлять электронные формулы многоэлектронных атомов, составлять графические формулы валентных электронов и определять валентности элементов.
Ключевые слова: атомная орбиталь, волновая функция, корпускулярно-волновой дуализм, главное квантовое число, орбитальное квантовое число, магнитное квантовое число, спиновое квантовое число, атомный радиус, энергия ионизации, энергия сродства к электрону.
Вопросы и задания
1. Современная модель строения атома.
2. Квантовые числа, их характеристика.
3. Принцип Паули, правило Гунда, правила Клечковского.
4. Электронные формулы элементов малых и больших периодов.
5. Определение валентности элементов, относящихся к разным типам семейств.
6. Современная формулировка периодического закона Д.И.Менделеева.
7. Свойства атомов, их изменение в периодах и группах.
Рекомендации: Проработать материал лекции и учебника, в тетради составить электронные формулы элементов согласно варианту глава III, определить валентности и степени окисления, подготовиться к тестированию.
Литература [1] – с.45-72, [2] – с.20-34, [3] – с.40-51.
СРС 5 Окислительно-восстановительные свойства атомов
Цель: По строению атома научиться определять характерные степени окисления и изменение окислительно-восстановительных свойств в зависимости от степени окисления.
Ключевые слова: степень окисления, окислительно-восстановительная реакция, окислитель, восстановитель, процесс окисления, процесс восстановления, окислительно-восстановительная двойственность, метод электронного баланса.
Вопросы и задания
1. Степень окисления, изменение свойств элементов в зависимости от степени окисления.
2. Окислительно-восстановительные реакции, процессы окисления и восстановления.
3. Метод электронного баланса.
4. Подготовиться к лабораторной работе.
Рекомендации: Проработать материал по учебнику, подготовиться к лабораторной работе: составить план проведения опытов, записать уравнения и уравнять методом электронного баланса.
Литература [1] – с 80-85, 259-267, [2] – с.251-258.
СРС 6 Метод полуреакций
Цель: Научиться дописывать уравнения химических реакций и уравнивать их методом полуреакций.
Вопросы и задания
1. Метод полуреакций.
2. Уравнять реакции методом полуреакций по [3] согласно варианту, глава YIII.
Рекомендации: Проработать материал по сборнику [3], в тетради для СРС выполнить задания.
Литература [1] – с.264-266, [3] – с. 167-170
Тема 3 Химическая связь и межмолекулярные взаимодействия
СРС 7 Ковалентная связь
Цель: Изучить методы образования химической связи и свойства ковалентной связи.
Ключевые слова: метод валентных связей, валентность, энергия связи, длина связи, направленность, насыщаемость, донор, акцептор, ковалентная связь, ионная связь.
Вопросы и задания
1. Как образуется ковалентная связь в методе валентных связей? Приведите примеры.
2. Рассмотрите свойства ковалентной связи на примере молекул воды, углекислого газа и ионов аммония.
3. Определите тип гибридизации в молекулах метана, хлорида бора, аммиака.
Рекомендации: Сначала проработать материал по лекции и материалу учебника, в тетради выполнить задание 2,3, запомнить основные определения и термины.
Литература [1] – с. 100- 105, 117-141, [2] – с.38-56.
СРС 8 Метод молекулярных орбиталей
Цель: Разобрать образование связи в бинарных молекулах по методу молекулярных орбиталей как ЛКАО.
Ключевые слова: молекулярная орбиталь, связывающие МО, разрыхляющие МО, парамагнитные свойства, диамагнитные свойства,
Вопросы и задания
1. Метод МО как линейная комбинация АО.
2. Разобрать образование частиц О2, О2- , N2 по ММО как ЛКАО.
Рекомендации: Проработать материал лекции и учебника, составить схемы образования частиц.
Литература: [1] – с.105-113, [2] – с. 57-65.
СРС 9 Межмолекулярные взаимодействия
Цель: Изучить виды взаимодействия между полярными и неполярными молекулами.
Ключевые слова: полярная молекула, неполярная молекула, взаимодействия: индукционное, ориентационное, дисперсионное, водородная связь.
Вопросы и задания
1. Водородная связь.
2. Силы Ван-дер-Ваальса – силы межмолекулярного взаимодействия.
Рекомендации: Самостоятельно проработать материал по учебнику и составить конспект. Привести примеры.
Литература: [1] – с.151-158, [2] – с.65-71.
Тема 4 Теория комплексных соединений Вернера
СРС 10 Комплексные соединения
Цель: Изучить и осмыслить основные положения теории Вернера, подготовиться к выполнению лабораторной работы по теме.
Вопросы и задания
1. Строение комплексных соединений.
2. Номенклатура комплексных соединений.
3. Свойства комплексных соединений.
4. Составить план проведения опытов, написать уравнения проводимых реакций.
Рекомендации: Проработать материла по учебнику, составить план отчета по работе.
Литература: [1] – с.354-376, [2] – с.71-81.
СРС 11,12 Подготовка к коллоквиуму
Цель: Проверка знаний по материалу тем 1-4.
Вопросы и задания:
1. Закон сохранения массы вещества. Основы атомно-молекулярного учения. Закон постоянства состава вещества. Закон кратных отношений.
2. Эквивалент. Закон эквивалентов. Определение эквивалентов оксидов, оснований, кислот и солей. Расчет эквивалентов в реакциях обмена.
3. Моль. Закон Авогадро. Мольный объем газа.
4. Современная модель строения атома.
5. Квантовые числа и их характеристика.
6. Принципы и правила заполнения атомных орбиталей (принцип Паули, правило Гунда, правила Клечковского)
7. Электронные формулы элементов малых и больших периодов. Определение валентности элементов, относящихся к разным типам семейств.
8. Современная формулировка периодического закона Д.И.Менделеева. Структура периодической таблицы.
9. Свойства атомов (атомный радиус, энергия ионизации, энергия сродства к электрону), их изменение в периодах и группах.
10. Окислительные и восстановительные свойства атомов. Степень окисления. Определение степени окисления по формуле вещества.
11. Важнейшие окислители и восстановители. Изменение окислительно-восстановительной способности в зависимости от степени окисления элемента.
12. Составление окислительно-восстановительных реакций и уравнивание их методом электронного баланса.
13. Классификация окислительно-восстановительных реакций.
14. Метод полуреакций при составлении окислительно-восстановительных реакций, протекающих в водных растворах.
15. Ковалентная связь. Обменный и донорно-акцепторный механизмы образования σ- и π-связи. Свойства ковалентной связи: насыщаемость, поляризуемость, направленность. Гибридизация, ее виды: sр-, sр2-, sр3.
16. Ионная связь и ее свойства.
17. Металлическая связь. Зонная теория металлов.
18. Водородная связь.
19. Межмолекулярное взаимодействие и его виды.
20. Комплексные соединения, строение, природа связи, константа нестойкости.
Рекомендации: проработать материал по учебнику и лекциям, знать основные определения и понятия, уметь на практике применять теоретические знания: составлять электронные и графические формулы элементов, определять валентности и степени окисления, записывать формулы соединений, составлять окислительно-восстановительные реакции и уравнивать их методом электронного баланса и полуреакций, знать структуру комплексных соединений, записывать уравнения диссоциации константы нестойкости комплексного соединения.
Литература: [1] – с.18-155, 354-376, [2] – с.10-81.
Тема 5 Химическая термодинамика
СРС 13. Термохимия. Закон Гесса.
Цель: Освоить методику решения задач на закон Гесса.
Ключевые слова: экзотермические реакции, эндотермические реакции, термохимичекое уравнение реакции, тепловой эффект, теплота образования, теплота сгорания, теплота нейтрализации, теплота растворения, теплота гидратации.
Вопросы и задания:
1. Закон Гесса и следствия из него.
2. Решить задачи на расчет тепловых эффектов реакций по [3] глава V согласно варианту.
Рекомендации: Проработать теоретический материал, решить задачи.
Литература: [2] – с.116-131
СРС 14. Определение теплоты гидратации безводного сульфата меди (II)
Цель: Подготовиться к проведению лабораторной работы.
Ключевые слова: теплота гидратации, теплоемкость, энергия кристаллической решетки.
Вопросы и задания:
1. Тепловые процессы при растворении.
2. Расчет тепловых эффектов при растворении, зная теплоемкость и массу растворенного вещества.
3. Составить план проведения опытов.
Рекомендации: Проработать материал по учебнику, составить план отчета по работе, освоить методику расчета теплового эффекта реакции растворения.
Литература: [1] – с.170-176, [2] – с.127-128.
СРС 15 Термодинамические законы
Цель: Изучить термодинамические законы, их смысл и значение.
Ключевые слова: система, процесс, параметры системы, термодинамические функции, термодинамические законы.
Вопросы и задания:
1. Первый закон термодинамики, формулировки, математическое выражение, смысл и значение.
2. Второй закон термодинамики, формулировки, математическое выражение, значение.
3. Третий закон термодинамики. Расчет энтропии вещества при фазовом переходе.
4. Подготовиться к терминологическому диктанту по теме «Химическая термодинамика».
Рекомендации: Проработать материал по учебнику и лекциям, составить глоссарий.
Литература: [1] – с.170-173, [2] – с.132-135.
СРС 16 Условия самопроизвольного протекания процессов
Цель: Научиться рассчитывать изменение энергии Гиббса и определять направление протекания процесса в изобарно-изотермических условиях.
Ключевые слова: энтропия, энтальпия, энергия Гиббса, внутренняя энергия.
Вопросы и задания:
1. Условия самопроизвольного протекания реакций.
2. Решить задачи на расчет энергии Гиббса и определение возможности протекания процесса по [3] глава V № 308, 312.
Рекомендации: В тетради для СРС решить задачи.
Литература: [1] – с.177-185, [2] – с.136-143.
Тема 6 Химическая кинетика
СРС 17 Скорость химических реакций
Цель: Углубить представления о скорости химических реакций и факторах, на нее влияющих, подготовиться к выполнению опытов и их осмыслению.
Ключевые слова: скорость реакции, парциальное давление, молярная концентрация, температурный коэффициент, закон действующих масс, закон Вант-Гоффа, катализатор, ингибитор.
Вопросы и задания:
1. Расчет скорости реакции для гомогенных и гетерогенных систем.
2. Факторы, влияющие на скорость химических реакций.
3. Катализ: гомогенный и гетерогенный.
4. Составить план проведения опытов по данной теме.
Рекомендации: Вопросы 1,2 проработать по материалу лекции и учебнику, для вопроса 3 составить краткий конспект, обратив внимание на причину увеличения скорости реакции в присутствии катализатора.
Литература: [1] – с.186-198, [2] – с.177-183.
CРC18 Решение задач по теме «Скорость химических реакций»
Цель: Научиться рассчитывать скорость химических реакций, изменение скорости в зависимости от условий протекания реакций.
Вопросы и задания:
1. Изучить закон действующих масс, закон Вант-Гоффа.
2. Решить задачи на определение скорости реакций по [3] глава V № 329, 330,332, 334, 335.
Рекомендации: Задачи решить в тетради по СРС.
Литература: [1] – с.194-198, [2] – с.167-176, 184-200.
СРС 19 Химическое равновесие
Цель: Осмыслить условия смещения химического равновесия, подготовиться к выполнению лабораторной работы.
Ключевые слова: обратимые и необратимые реакции, константа равновесия, принцип Ле Шателье, равновесные концентрации.
Вопросы и задания
1. Химическое равновесие, его характеристика.
2. Принцип Ле Шателье.
3. Составить план проведения опытов, написать уравнения химических реакций.
Рекомендации: На конкретных примерах разобрать правила смещения химического равновесия, примеры записать в тетрадь.
Литература: [1] – с.204-211, [2] – с.143-148.
СРС 20 Равновесия в гетерогенных системах
Цель: Изучить особенности химического равновесия в гетерогенных системах и фазового равновесия, подготовиться к терминологическому диктанту.
Ключевые слова: испарение, сублимация, возгонка, плавление, кристаллизация, конденсация, степень свободы, компонент, фаза, тройная точка.
Вопросы и задания
1. Константа равновесия в гетерогенных системах
2. Диаграмма состояния воды.
3. Составить глоссарий и тезаурус.
Рекомендации: Глоссарий по теме записать в тетрадь для СРС, составить конспект по вопросу 2.
Литература: [1] – с.204-214, [2] – с.149-158.
Тема 7 Растворы и дисперсные системы
СРС 21 Приготовление растворов заданной концентрации
Цель: Научиться проводить перерасчет из одной концентрации в другую, подготовиться к выполнению лабораторной работы.
Ключевые слова: раствор, растворитель, растворенное вещество, массовая доля, молярная концентрация, молярная концентрация эквивалентов, моляльная концентрация, титр.
Вопросы и задания
1. Пересчет концентрации раствора из одной в другую:
а) из массовой доли в молярную, моляльную концентрации и молярную концентрацию эквивалентов
б) из молярной концентрации в массовую долю.
2. Решить задачи по [3] глава VIII согласно варианту.
3. Составить план проведения опыта.
Рекомендации: В отчете написать формулы пересчета из одной концентрации в другую.
Литература: [3] – с.106-115.
СРС 22 Дисперсные системы
Цель: Изучить типы дисперсных систем, условия их образования и отличительные свойства от истинных растворов.
Ключевые слова: дисперсные системы, дисперсная фаза, дисперсионная среда, эмульсия, суспензия, аэрозоль, коллоидный раствор, двойной электрический слой, коагуляция, диализ, эффект Тиндаля.
Вопросы и задания
1. Классификация дисперсных систем по размеру частиц дисперсной фазы и по агрегатному состоянию дисперсной фазы и дисперсионной среды.
2. Строение коллоидной частицы и мицеллы. Разобрать на конкретном примере.
3. Методы получения коллоидных растворов.
4. Оптические свойства коллоидных растворов.
5. Кинетическая и агрегативная устойчивость коллоидных систем.
6. Роль коллоидных растворов в природе и технике.
Рекомендации: Проработать материал учебника и составить краткий конспект.
Литература: [1] – с.289-297, 306-311, [2] – с.242-250.
СРС 23 Растворы электролитов.
Цель: Повторить, углубить и обобщить знания о поведении слабых и сильных электролитов в водных растворах, изучить их количественные характеристики.
Вопросы и задания
1.Сильные и слабые электролиты, их характеристика.
2. Условия протекания реакций в водных растворах. Ионные уравнения реакций.
3. Произведение растворимости.
4. Составить план проведения опытов по теме и уравнения химических реакций.
Рекомендации: В тетради для СРС составить правила составления полных и сокращенных уравнений реакций в водных растворах, по плану проведения опытов составить уравнения химических реакций в молекулярном и ионном виде.
Литература: [1] – с.231-242, 245-247, [2] – с. 210 -224, 231-234, 241-242.
СРС 24 Гидролиз солей
Цель: Углубить и обобщить знания о гидролизе солей в водных растворах, изучить количественные характеристики процесса гидролиза.
Ключевые слова: гидролиз, необратимый гидролиз, степень гидролиза, константа гидролиза, водородный показатель, кислотность среды.
Вопросы и задания
1. Ионное произведение воды. Водородный показатель.
2. Гидролиз солей.
3. Составить план проведения опытов по теме и уравнения гидролиза солей в молекулярном и ионном виде.
Рекомендации: Проработать материал по учебнику и лекциям, по плану проведения опытов составить уравнения гидролиза солей в молекулярном и ионном виде.
Литература: [1] – с.241-259, [2] – с. 224 -231, 234-238.
СРС 25,26 Тестирование по темам 5-7
Цель: Подготовиться к тестированию по темам 5-7.
Вопросы и задания:
1. Уравнения химических реакций, в которых указывается тепловой эффект, называются:
2. Согласно следствию из закона Гесса тепловой эффект реакции равен:
3. Термохимия – это раздел химии, который изучает:
4. Тепловой эффект реакции образования – это:
5. На скорость химической реакции влияет:
6. Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. Это формулировка:
7. Уравнение Аррениуса устанавливает зависимость:
8. Уравнение Аррениуса имеет вид:
9. Уравнение Вант-Гоффа имеет вид:
10. Скорость химической реакции увеличивается в присутствии катализатора, так как:
11. Взаимодействие порошка алюминия с йодом происходит только в присутствии воды. Вода выступает как:
12. Фактор, не влияющий на состояние химического равновесия:
13. Формулировка принципа Ле-Шателье:
14. Константа равновесия для реакции Ств.+ 2Н2Ог. ↔ СО2 + 2Н2 имеет вид:
15. Для смещения равновесия в реакции N2 + 3Н2 ↔ 2NH3 + 92 кДж в сторону образования продукта реакции необходимо:
16. Равновесие процесса перехода вещества из одной фазы в другую без изменения химического состава называется:
17. Процесс перехода вещества из твердого состояния в газообразное, минуя жидкое называется:
18. Процесс перехода вещества из парообразного состояния в твердое, минуя жидкое называется:
19. Правило фаз Гиббса имеет следующий вид: С + Ф = К + n. Расшифруйте обозначения С, Ф, К, n.
20. Константа равновесия реакции 2NO2 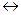 2NO + O2 при
2NO + O2 при
[NO2]=0,006 моль/л
[O2]=0,012 моль/л
[NO]=0,024 моль/л:
21 Реакция идет по уравнению 2NO + O2 = 2NO2. Концентрации исходных веществ были: [NO] = 0,03 моль/л; [O2] = 0,05 моль/л. Как изменится скорость реакции, если увеличить концентрацию кислорода до 0,10 моль/л и концентрацию NO до 0,06 моль/л?
22. Способы выражения концентрации растворов:
23. Количество молей вещества, содержащееся в 1 литре раствора – это:
24. Моляльная концентрация – это:
25. Молярная концентрация 5% раствора соляной кислоты (плотность принять равной 1 г/мл) равна:
26. Диссоциация электролита при растворении в воде происходит:
27. Отношение числа молекул, диссоциированых на ионы, к общему числу молекул растворенного электролита называется:
28. Электролит, который диссоциирует с образованием в качестве катиона только катиона водорода, называется:
29. Электролит, который диссоциирует с образованием в качестве аниона только анионов гидроксо группы, называется:
30. Электролиты, диссоциирующие как кислоты и основания, называются:
31. Количество ионов, образующихся при диссоциации сульфата натрия:
32. Количество катионов, образующихся при диссоциации ортофосфата калия:
33. Сумма коэффициентов в сокращенном ионном уравнении химической реакции между гидроксидом натрия и хлоридом хрома (III):
34. Полусумма произведений концентраций всех ионов, присутствующих в растворе, на квадрат их заряда называется:
35. Коэффициенты активности зависят от:
36. Ионное произведение воды – это:
37. По современным представлениям растворение – это:
38. Константой диссоциации называется:
39. Если вещество является слабым электролитом, диссоциирует в воде в три ступени, которые характеризуются константами равновесия К1, К2, К3, то каково будет соотношение констант.
40. Зависимость между константой диссоциации К и степенью диссоциации α выражается уравнением:
41. Концентрация ионов водорода в водном растворе соляной кислоты равна 10-5 моль/л. рН такого раствора равен:
42. рН водного раствора может изменяться в пределах:
43. Концентрация ионов гидроксильных групп в водном растворе гидроксида натрия равна 10-4 моль/л. рН такого раствора равен
44. Логарифм концентрации ионов водорода, взятый со знаком минус – это
45. Какова кислотность водного раствора а)карбоната натрия б)хлорида аммония.
46. Выражение констант гидролиза соли, образованной а) слабой кислотой и слабым основанием б) образованной слабой кислотой и сильным основанием в) образованной сильной кислотой и слабым основанием
47. Уравнение гидролиза хлорида цинка по первой ступени.
48. Почему при кипячении разбавленного водного раствора хлорида железа (III) наблюдается помутнение раствора?
49. При нагревании раствора ацетата натрия в присутствии индикатора фенолфталеина раствор окрашивается в малиновый цвет, а при охлаждении снова обесцвечивается. Почему это происходит?
50. Цвет лакмуса в водном растворе карбоната натрия?
51. Цвет метилоранжа в водном растворе хлорида аммония?
52. Цвет лакмуса в водном растворе ацетата аммония?
53. Цвет лакмуса в водном растворе нитрата алюминия?
54. Объем 10%-ного раствора карбоната натрия Na2CO3 (плотность 1,105 г/см3), который потребуется для приготовления 5 л 2%-ного раствора (плотность 1,02 г/см3) равен
55. Почему и как температура замерзания раствора отличается от температуры замерзания растворителя?
56. Почему и как t0 кипения раствора отличается от температуры кипения растворителя?
57. К каким растворам применимы законы Рауля и Вант-Гоффа?
58. Физический смысл криоскопической и эбуллиоскопической постоянной.
59. Что такое изотонический коэффициент?
60. Каково значение изотонического коэффициента для растворов электролитов и неэлектролитов?
Рекомендации: На вопросы ответить устно, задачи и задания выполнить письменно в тетради для СРС.
Литература: [1] – с.170-254, [2] – с.116-251.
Тема 8 Электрохимия
СРС 27 Гальванические элементы
Цель: Систематизировать и углубить представления об электродном потенциале, гальванических элементах, ряде стандартных электродных потенциалов.
Ключевые слова: электродный потенциал, гальванический элемент, электродвижущая сила элемента, стандартный водородный электрод, водородная шкала потенциалов, поляризация, перенапряжение.
Вопросы и задания
1.Поляризация и перенапряжение.
2. Решение типовых задач по [3] глава VIII на расчет электродных потенциалов, э.д.с. гальванических элементов.
Рекомендации: Проработать материал по учебнику и лекции, подготовиться к терминологическому диктанту, самостоятельно составить краткий конспект по вопросу 1, задачи решить тетради для СРС.
Литература: [1] – с.273-281, [2] – с.261-283.
СРС 28 Коррозия металлов
Цель: Углубить представления о термодинамике и кинетике процесса коррозии, подготовиться к проведению лабораторных опытов.
Ключевые слова: химическая коррозия, электрохимическая коррозия, скорость коррозии, кислородная деполяризация, водородная деполяризация, защитные покрытия, электрохимическая защита, протекторная защита.
Вопросы и задания
1. Электрохимическая коррозия.
2. Факторы, влияющие на коррозию металлов.
3. Защита металлов от коррозии
4. Составить план проведения опытов по теме и уравнения коррозии в молекулярном и ионном виде
Рекомендации: Проработать материал по учебнику и лекции, подготовиться к проведению лабораторной работы, самостоятельно составить краткий конспект по вопросу 3 в тетради для СРС.
Литература: [1] – с.685-694, [2] – с.310-337.
СРС 29 Электролиз
Цель: Систематизировать и углубить знания об электролизе растворов, научиться решать задачи с использованием законов Фарадея и рассчитывать молярные массы эквивалентов веществ в окислительно-восстановительных реакциях.
Ключевые слова: электролиз, инертный анод, растворимый анод, никелирование меднение, анодное покрытие, катодное покрытие.
Вопросы и задания
1. Электролиз растворов и расплавов минеральных веществ.
2. Последовательность электродных процессов.
3.Законы Фарадея. Применение электролиза при получении металлов
4. Решить задачи по [3] глава VIII № 698,702,707.
Рекомендации: Проработать материал по учебнику и лекции, решить задачи в тетради для СРС.
Литература: [1] – с 281-288, [2] – с.260 -261, 284-291.
СРС 30 Химические источники тока.
Цель: Углубить знания о химических источниках тока.
Ключевые слова: емкость элемента, энергия элемента, сохраняемость элемента, топливные элементы, аккумуляторы.
Вопросы и задания
1. Гальванические первичные элементы, их характеристика.
2. Топливные элементы, принцип их действия.
3. Аккумуляторы: свинцовые и щелочные, принцип их действия.
Рекомендации: Проработать материал по учебнику и самостоятельно составить краткий конспект по вопросу 3 в тетради для СРС.
Литература: [1] – с 681-685, [2] – с.300-310.
Вопросы для подготовки к экзамену:
1.Какой объем при н.у. занимает один моль газообразного вещества?
2. Сколько частиц содержит один моль вещества?
3. Какую формулировку имеет закон сохранения массы веществ, кто и когда его сформулировал?
4. Какова формулировка закона кратных отношений, кто и когда его сформулировал?
5. Что такое эквивалент?
6. Как рассчитать молярную массу эквивалентов оксида?
7. Как рассчитать молярную массу эквивалентов гидроксидов?
8. Как рассчитать молярную массу эквивалентов кислот?
9. Как рассчитать молярную массу эквивалентов солей?:
10. Как рассчитать молярную массу эквивалентов кислот в реакции нейтрализации?
11. Как рассчитать молярную массу эквивалентов окислителя в окислительно-восстановительных реакциях?
12. Как рассчитать молярную массу эквивалентов восстановителя в окислительно-восстановительных реакциях?
13. Как рассчитать молярную массу эквивалентов оксида, если известна молярная масса эквивалентов металла?
14. Закон эквивалентов. Применение закона эквивалентов для решения задач.
15. Какова формулировка закона постоянства состава вещества, когда и кем он был сформулирован?
16. Каково количество вещества, содержащее 1,8х1024 молекул углекислого газа?
17. Какова формулировка закона Авогадро? В каком году он был сформулирован?
18. Что такое атом? Молекула? Химический элемент?
19. Какой объем при н.у занимает углекислый газ массой 22 г?
20. Что такое относительная атомная масса, молекулярная масса? молярная масса?
21. Вещество А, получаемое в результате следующей схемы превращения:
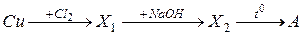
22. Вещество А, получаемое в результате следующей схемы превращения:
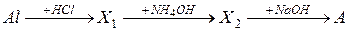
23. В результате какой реакции нельзя получить соль?
24. Какое основание называется амфотерным?
25.Каковы химические свойства кислот?
26. Каковы химические свойства кислотных оксидов?
27. Каковы химические свойства щелочей?
28. Каковы химические свойства солей?
29. Вещество А, получаемое в результате схемы превращения:
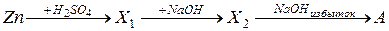
30. Каковы химические свойства основных оксидов?
31. Каковы химические свойства нерастворимых в воде оснований?
32.Что образуется при взаимодействии щелочных металлов с водой?
33. Какие металлы не реагируют с разбавленной серной кислотой?
34. Вещество А, получаемое в результате следующей схемы превращения
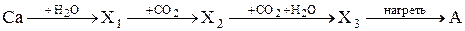
35. Вещество А, получаемое в результате следующей схемы превращения
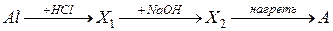
36. С какими веществами не реагирует раствор гидроксида натрия?
37. С какими веществами не реагирует раствор серной кислоты?
38. С какими веществами не реагирует раствор сульфата железа (+3)?
39. С какими из перечисленных веществ не реагирует оксид натрия
40. С какими веществами не реагирует оксид фосфора (+5)?
41. Что характеризует главное квантовое число?
42. Какое значение может принимать орбитальное (побочное) квантовое число, если главное квантовое число равно 4?
43. Какие значения может иметь магнитное  квантовое число, если побочное (орбитальное) квантовое число равно 3?
квантовое число, если побочное (орбитальное) квантовое число равно 3?
44. Что такое изотопы и как они обозначаются?
45. Что такое изобары и как они обозначаются?
46. Какое количество протонов, нейтронов и электронов в изотопе 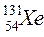 ?
?
47. Каково значение для 4f-подуровня главного и побочного (орбитального) квантовых чисел?
48. Какое максимальное число электронов может располагаться на s, p, d и f подуровнях?
49. Какова электронная формула иона 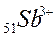 ?
?
50. Как будут распределяться в соответствии с принципом Гунда 7 электронов на 4f-подуровне?
51. Почему свойства элементов и их соединений в периодической таблице повторяются?
52. Какие связи относятся к внутримолекулярным химическим связям?
53. Какие взаимодействия относятся к межмолекулярным?
54. Каковы тип гибридизации и форма молекулы Н2О?
55. Что такое насыщаемость ковалентной связи и как ее определить?
56. Какие свойства характеризуют не только ковалентную связь?
57. Что такое электроотрицательность?
58. Как определяется полярность химической связи?
59. Между атомами каких элементов образуется ионная химическая связь?
60. Между атомами каких элементов образуется ковалентная химическая связь?
61.От каких параметров зависит полярность молекул?
62. Каков тип гибридизации, если валентный угол между связями составляет 109028′?
63. Что характеризует магнитное квантовое число?
64. Какова кратность химической связи в частице 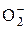 и ее магнитные свойства согласно методу ЛКАО метода молекулярных орбиталей?
и ее магнитные свойства согласно методу ЛКАО метода молекулярных орбиталей?
65. Каковы основные положения метода МО как ЛКАО?
66. Как называется комплексное соединение Na[Al(OH)4]?
67. Как называется комплексное соединение [Cu(NH3)4]SO4?
68.Что является в комплексном соединении K3[Fe(CN)6] ионом комплексообразователем?
69. Каковы структурные элементы комплексного соединения K4[Fe(CN)6]?
70. Каков заряд иона комплексообразователя в комплексном соединении Na3[Co(NO2)6]?
71. Каков тип связи между внешней и внутренней координационными сферами в комплексных соединениях?
72. Каков тип связи между комплексообразователем и лигандами?
73. В состав комплексного соединения входят: Co3+, 5NH3, 3Cl-. На взаимодействие 1 моль комплексного соединения требуется 2 моль нитрата серебра. Какова структура комплексного соединения?
74. Какова формула комплексной соли, которая образуется при взаимодействии хлорида железа (III) и желтой кровяной соли K4[Fe(CN)6]?
75. При взаимодействии хлорида железа (II) и гексацианоферрата(+3) калия образуется осадок синего цвета. Какова формула вещества выпавшего в осадок?
76. Какова формула соединения, образующаяся при взаимодействии хлорида хрома (III) с избытком гидроксида натрия?
77. Какова формула константы нестойкости для комплексного иона [Cu(NH3)4]2+?
78. Какова формула константы устойчивости для комплексного иона [Fe(SCN)6]3-?
79. Каким соотношением связаны константа нестойкости и устойчивости между собой?
80. Что такое комплексные соединения?
81. Кем была впервые разработана теория комплексных соединений?
82. Каков тип гибридизации и структура комплексного иона [Cu(NH3)2]+?
83. Каков тип гибридизации и структура комплексного иона [Zn(NH3)4]2+?
84. Что такое координационное число?
85. Какие ионы и молекулы могут выступать в качестве лигандов?
86. Какие уравнения химических реакций называются термохимическими?
87. Каков тепловой эффект реакции С + 1/2О2 ® СО + Q, если известны термохимические уравнения реакций:
С + О2 ® СО2 + 393,5 кДж
СО + 1/2О2 ®СО2 + 283,0 кДж?
88. Каков тепловой эффект перехода алмаза в графит, если известны термохимические уравнения реакций горения алмаза и графита:
Салмаз + О2 ® СО2 + 395,4 кДж
Сграфит + О2 ® СО2 + 393,5 кДж
Салмаз ® Сграфит + Q?
89. Каков тепловой эффект перехода угля в графит, если известны термохимические уравнения реакций горения угля и графита:
Суголь + О2 ® СО2 + 409,2 кДж
Сграфит + О2 ® СО2 + 393,5 кДж
Суголь ® Сграфит + Q?
90. Каков тепловой эффект реакции 2Fe + 3H2O ® Fe2O3 + 3H2 + Q, если известно, что тепловой эффект образования воды и тепловой эффект образования оксида железа (+3) соответственно равны 241,82 кДж/моль и 822,2 кДж/моль?
91. Как можно рассчитать тепловой эффект реакции?
92. Что изучает термохимия?
93. Что называется тепловым эффектом реакции образования?
94. Какие факторы влияют на скорость химической реакции?
95. Какова формулировка закона действующих масс?
96. Что такое температурный коэффициент?
97. Какую зависимость устанавливает уравнение Аррениуса?
98. Каково математическое выражение уравнения Вант-Гоффа?
99. Почему скорость химической реакции увеличивается в присутствии катализатора?
100. Взаимодействие порошка алюминия с йодом происходит только в присутствии воды. Какую роль играет вода?
101. Какой фактор не влияет на состояние химического равновесия?
102. Формулировка принципа Ле-Шателье?
103.Какой вид имеет константа равновесия для реакции
Ств.+ 2Н2Ог. ↔ СО2 + 2Н2?
104. Как необходимо изменить внешние параметры для смещения равновесия в реакции N2 + 3Н2 ↔ 2NH3 + 92 кДж в сторону образования продукта реакции?
105. Как называется равновесие процесса перехода вещества из одной фазы в другую без изменения химического состава?
106. Как называется процесс перехода вещества из твердого состояния в газообразное минуя жидкое?
107.. Как называется процесс перехода вещества из парообразного состояния в твердое минуя жидкое?
108. Правило фаз Гиббса имеет следующий вид: С + Ф = К + n
Что обозначает параметр С?
109. Правило фаз Гиббса имеет следующий вид С + Ф = К + n
Что обозначает параметр К?
110. Какое значение имеет константа равновесия реакции 2NO2 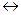 2NO + O2 при [NO2]=0,006 моль/л, [O2]=0,012 моль/л, [NO]=0,024 моль/л?
2NO + O2 при [NO2]=0,006 моль/л, [O2]=0,012 моль/л, [NO]=0,024 моль/л?
111 Реакция идет по уравнению 2NO + O2 = 2NO2. Концентрации исходных веществ были: [NO] = 0,03 моль/л; [O2] = 0,05 моль/л. Как изменится скорость реакции, если увеличить концентрацию кислорода до 0,10 моль/л и концентрацию NO до 0,06 моль/л?
112. Каковы способы выражения концентрации растворов?
113. Как называется концентрация раствора, определяющая количество молей вещества в 1 литре раствора?
114. Моляльная концентрация – это?
115. Какова молярная концентрация 5% раствора соляной кислоты (плотность принять равной 1 г/мл)?
116.Какова молярная концентрация 1% раствора гидроксида натрия (плотность принять равной 1 г/мл)?
117. Диссоциация электролита при растворении в воде происходит:
118. Что такое степень диссоциации?
119.Кислота с точки зрения теории электролитической диссоциации – это?
120. Основание с точки зрения теории электролитической диссоциации – это?
121. Как называются электролиты, диссоциирующие как кислоты и основания?
122. Количество ионов, образующихся при диссоциации сульфата алюминия:
123. Какое количество катионов образуется при диссоциации ортофосфата натрия?
124. Какова сумма коэффициентов в сокращенном ионном уравнении химической реакции между гидроксидом натрия и хлоридом железа (III):
125. Что такое ионная сила раствора?
126. От каких факторов зависят коэффициенты активности?
127. В области разбавленных растворов (С<0,1 моль/л) коэффициенты активности зависят главным образом от концентрации и заряда ионов, присутствующих в растворе, и мало зависят от природы растворенных веществ. Как называется эта закономерность?
128. Что называется ионным произведением воды?
129. По современным представлениям растворение – это?
130. Как называется константа равновесия, отвечающая диссоциации слабого электролита?
131. Если вещество является слабым электролитом, диссоциирует в воде в три ступени, которые характеризуются константами равновесия К1, К2, К3, то каково соотношение констант?
132. Какова зависимость между константой диссоциации К и степенью диссоциации α?
133. Концентрация ионов водорода в водном растворе соляной кислоты равна 10-3 моль/л. Каково значение рН такого раствора?
134. В каких пределах может изменяться рН водного раствора?
135. Концентрация ионов гидроксильных групп в водном растворе гидроксида натрия равна 10-2 моль/л. Каково значение рН такого раствора?
136. Логарифм концентрации ионов водорода, взятый со знаком минус – это?
137. Чему равна кислотность водного раствора карбоната натрия?
138. Чему равна кислотность водного раствора хлорида аммония?
139. От какого фактора не зависит константа гидролиза соли?
140. Каково математическое выражение константы гидролиза соли, образованной слабой кислотой и сильным основанием?
141. Каково математическое выражение константы гидролиза соли, образованной сильной кислотой и слабым основанием?
142. При гидролизе каких солей рН раствора будет меньше семи?
143. При гидролизе каких солей рН раствора будет больше семи?
144. Каково уравнение гидролиза соли карбоната натрия по первой ступени?
145. Каково уравнение гидролиза хлорида цинка по первой ступени?
146. Почему при кипячении разбавленного водного раствора хлорида железа (III) наблюдается помутнение раствора?
147. Почему при нагревании раствора ацетата натрия в присутствии индикатора фенолфталеина раствор окрашивается в малиновый цвет, а при охлаждении снова обесцвечивается?
148. Какой цвет лакмуса в водном растворе карбоната натрия?
149. Какой цвет метилоранжа в водном растворе хлорида аммония?
150. Какой цвет лакмуса в водном растворе ацетата аммония?
151. Какой цвет лакмуса в водном растворе нитрата алюминия?
152 Какой объем 10%-ного раствора карбоната натрия Na2CO3 (плотность 1,105 г/см3) потребуется для приготовления 5 л 2%-ного раствора (плотность 1,02 г/см3)?
153. Опишите фазовую диаграмму состояния воды:
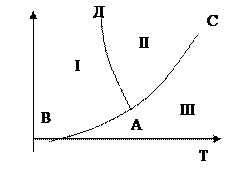 |
154. Почему и как температура замерзания раствора отличается от температуры замерзания растворителя?
155. Почему и как t0 кипения раствора отличается от температуры кипения растворителя?
156. К каким растворам применимы законы Рауля и Вант-Гоффа?
157. Каков физический смысл криоскопической постоянной?
158. Каков физический смысл эбуллиоскопической постоянной?
159. Что такое изотонический коэффициент?
160. Какое значение может принимать изотонический коэффициент для растворов электролитов?
161. Какие соединения могут проявлять только окислительные свойства?
162. Какие из перечисленных соединений KMnO4, K2Cr2O7, H2S, S, NH3, H2SO4 являются только восстановителями в реакциях? Почему?
163. До каких степеней окисления в зависимости от кислотности среды может восстанавливаться перманганат калия?
164. Какова сумма коэффициентов в уравнении реакции:
Cu + HNO3 = Cu(NO3)2 + NO + H2O?
165. Какова сумма коэффициентов в уравнении реакции:
KMnO4 + Na2SO3 + H2SO4 = MnSO4 + Na2SO4 + K2SO4 + H2O?
166. Какова сумма коэффициентов в уравнении реакции:
KMnO4 + Na2SO3 + H2O = MnO2 + Na2SO4 + KOH?
167. Какова сумма коэффициентов в уравнении реакции:
KMnO4 + Na2SO3 + КОН = К2МnO4 + Na2SO4 + H2O?
168. Какие реакции относятся к окислительно-восстановительным?
169. Что называется степенью окисления элемента?
170. Какие из перечисленных соединений в зависимости от условий могут проявлять как окислительные свойства, так и восстановительные S, SO2, H2SO4, NH3, HNO3, NaNO2?
171. В 5 сосудов поместили растворы солей: хлорида натрия, сульфата цинка, нитрата серебра, нитрата магния, хлорида алюминия и опустили туда железную пластину. В каком растворе произойдет реакция замещения?
172. Раздел химии, который изучает процессы превращения химической энергии в электрическую и процессы превращения электрической энергии в химическую – это?
173. Что такое гальванический элемент?
174. Что называется электродным потенциалом?
175. Из чего состоит стандартный водородный электрод?
176. Как называется уравнение, устанавливающее зависимость потенциала электрода от температуры и концентрации иона металла в растворе?
177. Потенциал какого электрода определяет уравнение 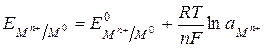 ?
?
178. Чему равен электродный потенциал серебра в растворе нитрата серебра, в котором активность серебра составляет 0.1 моль/л, если 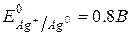 ?
?
179. Что называется стандартным потенциалом металлического электрода?
180. Чему равен окислительно-восстановительный потенциал электрода, на котором происходит восстановление 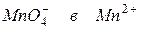 в кислой среде, если
в кислой среде, если 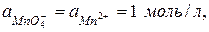 рН = 10,
рН = 10, 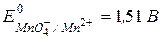 ?
?
181 Какова схема медно-кадмиевого гальванического элемента, если 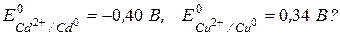
182.Чему равна э.д.с. медно-кадмиевого гальванического элемента, в котором активность ионов 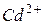 составляет 0,1 моль/л, ионов
составляет 0,1 моль/л, ионов 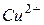 - 0,01 моль/л
- 0,01 моль/л 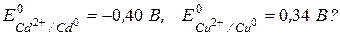
183. Чему равна э.д.с. концентрационного гальванического элемента с концентрацией ионов цинка в одном полуэлементе – 0,001 М, а в другом – 0,1 М, 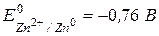 ?
?
184. Как называется максимальная разность потенциалов, которая может быть получена при работе гальванического элемента?
185.Каким соотношением связаны электродвижущая сила и энергия Гиббса?
186. 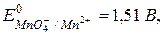
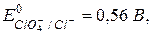
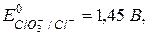 Какой ион является самым сильным окислителем из приведенного ряда?
Какой ион является самым сильным окислителем из приведенного ряда?
187. В каком случае будет наблюдаться выделение водорода на обеих пластинах, помещенных в раствор серной кислоты?
188. Какие металлы должны входить в гальванический элемент, чтобы значение э.д.с. было наибольшим при его работе?
189. При электролизе раствора какой соли на катоде будет выделяться водород, а на аноде кислород?
190. На катоде будет выделяется только металл при электролизе раствора какой соли?
191. Железо покрыто оловом. Какой металл будет разрушаться в первую очередь при нарушении покрытия в атмосфере?
192. Какой металл разрушается при нарушении цинкового покрытия железа в атмосфере?
193. Какие металлы можно получить только электролизом расплавов?
194. Какие металлы можно получить электролизом, как расплава, так и раствора?
195. Требуется скрепить железные детали. Какими заклепками следует пользоваться для замедления коррозии деталей?
196. Почему алюминий на воздухе не подвергается коррозии?
197. Какие анионы ускоряют коррозию?
198. В каком порядке восстанавливаются ионы металлов Cu2+, Ag+, Zn2+, Ni2+ при электролизе из водного раствора?
199. Сколько граммов меди выделится на катоде при электролизе раствора CuSO4 в течение 0,5 ч при силе тока 2 А?
200. Медь не вытесняет водород из разбавленных кислот. Однако если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то происходит его выделение. Почему?
201. Что такое коррозия?
202. Какие виды коррозии известны?
203. Что такое скорость коррозии? Как ее можно характеризовать?
204. Какие факторы влияют на скорость коррозии?
205. Какие способы защиты от коррозии известны? На чем они основаны?
206. Что такое электролиз?
207. Какие процессы протекают на катоде при электролизе из водных растворов солей?
208. Какие процессы протекают на аноде при электролизе из водных растворов солей?
209. Каковы области применения электролиза?
210. Почему щелочные и щелочноземельные металлы нельзя получить электролизом водных растворов солей? 
Варианты заданий домашней контрольной работы (сборник: «Задачи и упражнения по общей химии», автор Н.Л.Глинка, 1986.)
| № вари-анта глава | № задачи | ||||||||
| I | II | III | Y | Y | YI | YI | YI | YIII | |
| 1. | 633 (а) | ||||||||
| 2. | 182 (е,ж) | 633(б) | |||||||
| 3. | 182 (г,д) | 633 (в) | |||||||
| 4. | 634 (а,б) | ||||||||
| 5. | 634 (в,г) | ||||||||
| 6. | 190(б,г,е) | 634(д,е) | |||||||
| 7. | 190 (а,в,д) | 635 (а,б) | |||||||
| 8. | 635(в,г) | ||||||||
| 9. | 636(а,б) | ||||||||
| 10. | 636(в,г) | ||||||||
| 11. | 11, | 640 (в,г) | |||||||
| 12. | 640 (в,г) | ||||||||
| 13. | 639 (в,г) | ||||||||
| 14. | 640(а,б) | ||||||||
| 15. | 640(в,г) | ||||||||
| 16. | 182(а,б,в) | 639(а,б) | |||||||
| 17. | 632(г,д) |
Список литературы
Основная литература
1. Глинка Н.Л. Общая химия: Учебное пособие /Под ред А.И.Ермакова - М.: Интеграл-Пресс, 2002 – 728 с.
2. Коровин Н.В. Общая химия: учебник для технических напр. и спец. вузов -М.: Высшая школа, 2000 – 558 с.
3. Глинка Н.Л. Задачи и упражнения по общей химии. /Под ред. Рабиновича В.А. и Рубинной Х.М. – Л.: Химия, 1986 -272 с.
4. Барулина И.В. Практикум по химии - Рудный, РИИ, 2006 – 60 с.
Дополнительная литература
1 Фролов В.В. Химия М.: Высшая школа, 1986 – 543 с.
2 Ахметов Н.С. Общая и неорганическая химия. - М.: Высшая школа, 2002 – 743с.
3 Общая химия: Учебник /Под ред. Е.М.Соколовской и Л.С.Гузея – М.: изд. МГУ, 1998 – 640 с.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РЕСПУБЛИКИ КАЗАХСТАН
Рудненский индустриальный институт
РассмотренО
на заседании кафедры ПЭиХ
Протокол № 03 от 17.10.06
Заведующий кафедрой Куликова Г.Г.
 2015-01-30
2015-01-30 1066
1066